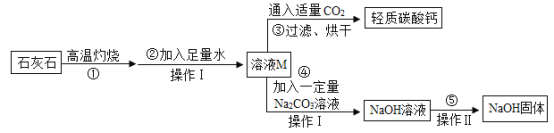
题目内容
【题目】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
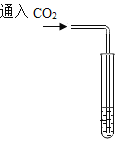
Ⅰ.制氢:①![]() ②
②![]()
Ⅱ.贮氢:③![]() 。
。
下列说法不正确的是
A.反应②中 ZnFe2O4中的铁元素的化合价为+3
B.反应①为分解反应,反应②③是置换反应
C.该制氢的不足之处是:反应需温度较高,消耗大
D.熔炼制备Mg2Cu合金时,需要通入氩气,目的是防止镁、铜在高温下与氧气反应
【答案】B
【解析】
A. 化合物中元素的化合价代数和为零,化合物中:锌显+2价,氧显-2价,反应②中 ZnFe2O4中的铁元素的化合价为+3,选项正确,不符合题意;
B. 一种单质和一种化合物生成另一种单质和另一种化合物,属于置换反应,反应①为“一变多”,是分解反应,反应②③不属于任何基本反应类型,选项错误,符合题意;
C. 由题中信息可知,该制氢的方法不足之处是:反应需温度较高,消耗能量大,选项正确,不符合题意;
D.在一定温度下,铜、镁都能与氧气反应生成氧化物,熔炼制备Mg2Cu合金时,需要通入氩气,可隔绝氧气,防止镁、铜在高温下与氧气反应,选项正确,不符合题意。
故选B。

 新题型全程检测期末冲刺100分系列答案
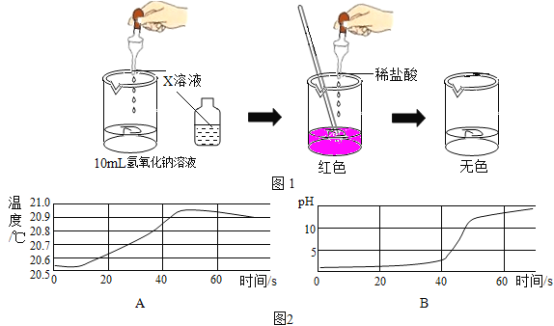
新题型全程检测期末冲刺100分系列答案【题目】一次化学兴趣小组活动中,老师拿来一瓶标签有破损的试剂瓶,如下图,里面盛有一种无色溶液。该化学兴趣小组的同学对此展开探究:
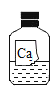
(提出问题)这瓶无色溶液的溶质是什么呢?
(作出猜想)猜想一:CaCO3;
猜想二:CaCl2;
猜想三:Ca(OH)2;
猜想四:Ca(NO3)2。
(讨论交流)讨论后,大家一致认为猜想一是错误的,其理由是________。
(查阅资料)CaCl2溶液、Ca(NO3)2溶液均呈中性。
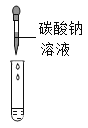
(实验探究)为验证其余猜想,小组的四位同学分别设计了如下实验:
实验编号 | 实验一 | 实验二 | 实验三 | 实验四 |
实验方案 |
|
|
|
|
实验现象 | 产生白色沉淀 | 产生白色沉淀 | 产生红褐色沉淀 |
(得出结论)猜想三成立,此无色溶液为Ca(OH)2溶液。
(表达交流)(1)实验一的现象是_________。
(2)实验二的化学反应方程式为___________。
(3)小组同学经过讨论,一致认为实验三不能证明猜想三成立,其理由是__________。
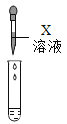
(拓展迁移)(1)实验四中的X溶液可以是_______(填化学式)溶液。
(2)取用化学试剂时为防止标签受损,倾倒液体时应________。