题目内容
二甲醚是一种应用前景广阔的清洁燃料.完全燃烧二甲醚4.6g,生成C028.8g,H2O 5.4g,下列判断不正确的是( )
A.二甲醚由C、H两种元素组成 B.二甲醚中C、H元素的质量比为4:1
C.二甲醚中H的质量分数为13% D.4.6g二甲醚完全燃烧消耗O29.6g
A
解析试题分析:由题意,完全燃烧二甲醚4.6g,生成C028.8g,H2O 5.4g,8.8gC02中含碳元素的质量为8.8g×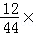 100%=2.4g,H2O5.4g中含氢元素的质量为5.4g×
100%=2.4g,H2O5.4g中含氢元素的质量为5.4g×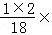 100%=0.6g.
100%=0.6g.
A、由质量守恒定律,反应前后,元素种类、质量不变,二甲醚中C、H元素的质量之和为2.4g+0.6g=3g<4.6g,则二甲醚中一定含有氧元素,故选项说法错误.
B、由质量守恒定律,反应前后,元素种类、质量不变,二甲醚中C、H元素的质量分别为2.4g、0.6g,则二甲醚中C、H元素的质量比为2.4g:0.6g=4:1,故选项说法正确.
C、二甲醚中H的质量分数为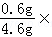 100%≈13%,故选项说法正确.
100%≈13%,故选项说法正确.
D、由质量守恒定律,4.6g二甲醚完全燃烧消耗O2的质量为8.8g+5.4g﹣4.6g=9.6g,故选项说法正确.
故选A.
考点:质量守恒定律及其应用.
点评:本题难度不大,理解质量守恒定律(反应前后,元素种类、质量不变)并能灵活运用是正确解答本题的关键.

 应用题作业本系列答案
应用题作业本系列答案煅烧石灰石可制得氧化钙(石灰石中的杂质不含钙、碳元素,且不参与反应)。测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3,则已分解的碳酸钙占原碳酸钙的质量分数是
| A.60% | B.50% | C.40% | D.30% |
27克氯化铜样品(其中混有少量其它盐类),与足量的硝酸银溶液反应生成氯化银沉淀58克,则可能混有的盐是( )
| A.FeCl2 | B.BaCl2 | C.ZnCl2 | D.KCl |
李大爷家使用的化肥是不纯的硝酸铵(NH4NO3),经测定其中氮元素的质量分数为37%,请你通过计算推测这种化肥所含的一种杂质可能是
| A.NH4HCO3 | B.NH4Cl |
| C.CO(NH2)2 | D.(NH4)2SO4 |
K2CO3是草木灰的主要成分,下列说法正确的是
| A.K2CO3中钾、碳、氧三种元素的质量比为2:1:3 |
B.K2CO3中C元素的质量分数为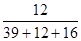 ×100% ×100% |
| C.K2CO3溶液含有K+、C2+、和O2- |
| D.K2CO3溶液能导电,是因为溶液中存在大量自由移动的离子 |
