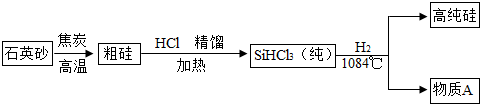
题目内容
 (2012?徐汇区二模)将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示.
(2012?徐汇区二模)将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示.①B点表示的含义是
盐酸与氢氧化钠恰好完全反应
盐酸与氢氧化钠恰好完全反应
,化学方程式为NaOH+HCl═NaCl+H2O
NaOH+HCl═NaCl+H2O
.②从A到B过程中,烧杯中溶液的pH逐渐
变小
变小
.③C处溶液中溶质是
NaCl、HCl
NaCl、HCl
,为了得到该溶液中的溶质晶体,可采用的合理方法是b
b
.a.冷却结晶 b.蒸发结晶
c.冷却热饱和溶液 d.加硝酸银溶液后过滤.
分析:①根据图象可以看出随着硫酸的加入温度在逐渐的上升,B点对于温度是个转折点,对于反应进程也是个转折点.
②分析A到B的过程的反应实质是氢氧根离子逐渐减少,即氢氧化钠逐渐减少;
③分析B到C的过程的反应实质,加入的稀盐酸逐渐增多,稀盐酸过量,可根据氯化钠的溶解性判断结晶方法.
②分析A到B的过程的反应实质是氢氧根离子逐渐减少,即氢氧化钠逐渐减少;
③分析B到C的过程的反应实质,加入的稀盐酸逐渐增多,稀盐酸过量,可根据氯化钠的溶解性判断结晶方法.
解答:解①根据图象可以看出随着稀盐酸的加入,温度在逐渐的升高,既然是盐酸中和氢氧化钠的反应是放热,在B点前后温度是两种情况,所以B点代表了反应的两种情况,故在B点恰好完全反应,反应后生成氯化钠和水,化学方程式为NaOH+HCl═NaCl+H2O
②A到B盐酸逐渐的与氢氧化钠反应,溶液由碱性逐渐的变为中性,溶液的pH逐渐减小;
③B到C的溶液中,是盐酸中和完氢氧化钠后继续加入盐酸,盐酸过量,故溶液中的溶质既有氯化钠还有氯化氢,想得到该溶液中的溶质晶体,只能得到氯化钠晶体,因为氯化氢是气体,故可采用蒸发溶剂的方法得到晶体;
故答案为:
①盐酸与氢氧化钠恰好完全反应,NaOH+HCl═NaCl+H2O;
②减小(或变小)
③NaCl、HCl; b.
②A到B盐酸逐渐的与氢氧化钠反应,溶液由碱性逐渐的变为中性,溶液的pH逐渐减小;
③B到C的溶液中,是盐酸中和完氢氧化钠后继续加入盐酸,盐酸过量,故溶液中的溶质既有氯化钠还有氯化氢,想得到该溶液中的溶质晶体,只能得到氯化钠晶体,因为氯化氢是气体,故可采用蒸发溶剂的方法得到晶体;
故答案为:
①盐酸与氢氧化钠恰好完全反应,NaOH+HCl═NaCl+H2O;
②减小(或变小)
③NaCl、HCl; b.
点评:本题主要考查了结合图象对中和反应的更深层次的理解,要抓住图象中的转折点,分析反应的实质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2012?徐汇区二模)甘氨酸是最简单的天然氨基酸.甘氨酸分子结构模型如右图所示,根据模型判断关于甘氨酸的叙述错误的是( )
(2012?徐汇区二模)甘氨酸是最简单的天然氨基酸.甘氨酸分子结构模型如右图所示,根据模型判断关于甘氨酸的叙述错误的是( )