��Ŀ����
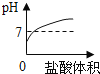
����Ŀ����1��ijѧ����̽����У������������������ձ��в�ע��һ������ϡ�����У��ܹ۲쵽�������У�������������___________����������Һ��___________����ȫ��Ӧ���ձ��ײ���__________���֡���д���йػ�ѧ����ʽ___________������һ���������������ϡ�����У��տ�ʼû���������ɣ����û�ѧ����ʽ���ͣ�___________��
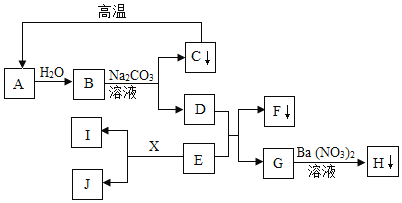
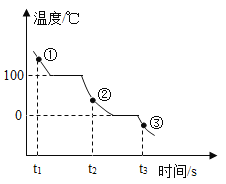
��2��A��B��C �������ʵ��ܽ��������ͼ����ش��������⡣
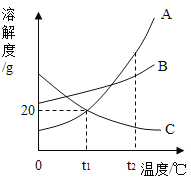
�� t1��ʱ��A���ʵ��ܽ����___________��
�� �����¶Ȳ��佫B�IJ�������Һת��Ϊ������Һ���ɲ��õ�һ�ַ�����___________��
�۽� t2��ʱ������A��B��C�������ʵı�����Һ������t1�棬������Һ���ܼ��������ٵ���___________��ѡ����A������B������C������
��t1��ʱ��A��B��C�������ʸ�5g�ֱ����20gˮ�г���ܽ⣬������Һ�����Ĵ�С��ϵΪ___________��
��50g��98%��Ũ����Ҫ���Ƴ�20%��ϡ���ᣬ��Ҫ���� ___________g ��ˮ��
���𰸡����� dz��ɫ ��ɫ���� Fe+H2SO4=FeSO4+H2�� Fe2O3+3H2SO4��Fe2(SO4)3+3H2O 20g ��������B(����������ܼ�) A B>A��C 195
��������
��1�������Ļ����Hǰ�棬�������ᷴӦ����H2�������������������ݲ�����
�������û���Ӧ��ֻ�������������ӣ��������ӵ���ɫΪdz��ɫ�������е�̼�����ᷴӦ����˷�Ӧ����ɲ��������ձ��ײ�������ϡ���ᷴӦ����������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2����
���������ı�����������������ϡ�����У�������������ϡ���ᷴӦ������������ˮ����ѧ����ʽΪ��Fe2O3+3H2SO4��Fe2(SO4)3+3H2O����˸տ�ʼû���������ɣ�
������ݣ�dz��ɫ����ɫ���壻Fe+H2SO4=FeSO4+H2����Fe2O3+3H2SO4��Fe2(SO4)3+3H2O��
��2�����ܽ�������к���������¶ȣ�����������ܽ�ȣ�ͨ�������ܽ�����߿�֪��t1��ʱ��A��Ӧ���ܽ����20g�����20g��
�ڲ�������Һת���ɱ�����Һ�ķ����иı��¶ȡ��������ʡ������ܼ���������Ҫ���¶Ȳ������Կɲ��õ��ǣ���������B����������ܼ��������������B������������ܼ�����
��t2��ʱ��A���ʵ��ܽ�����C���ʵ��ܽ����С��������A��B��C�������ʵı�����Һ�У�A�е��ܼ����٣�C�е��ܼ���࣬������t1�棬����Ӱ���ܼ�������������������Һ���ܼ��������ٵ���A�����A��
��t1��ʱ��B���ʵ��ܽ�ȴ���20g��A��C���ʵ��ܽ����20g�����Խ�A��B��C�������ʸ�5g�ֱ����20gˮ�г���ܽ⣬B�����ܽ�Ķ࣬A��C�����ܽ���٣���������ȣ�����������Һ�����Ĵ�С��ϵΪB>A��C�����B>A��C��
�ݸ�����Һϡ��ǰ�������������䣬����Ҫ����ˮ������Ϊx����50g��98%=��50g+x����20%��x��195g�����195��

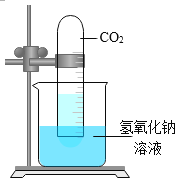
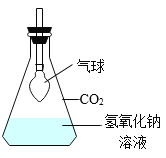
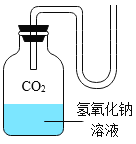
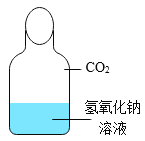
����Ŀ����ѧ��һ����ʵ��Ϊ������ѧ�ƣ���ͼ��һ��̽�� CO2 ��NaOH �ܷ�Ӧ��ʵ�顣
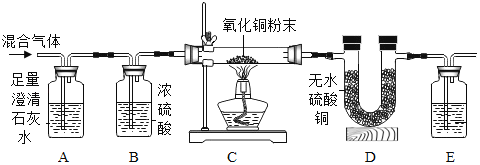
ʵ�� | A | B | C | D | E |
ʵ��װ�� |
|
|
|
|
�����켦�� |
��1������д��Ӧ��ʵ������A______________�� B_____________�� C_______________�� D_____________�� E_______________��
��2����ͼ 1 װ�ý���ʵ�飬�Ⱥ� 2 ��ע�����е���Һ����ȫ�����룬���һ��ʱ����װ����ѹǿ�仯��ͼ 2 ��ʾ�����������Һ��____________��
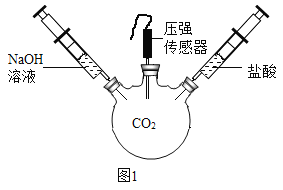
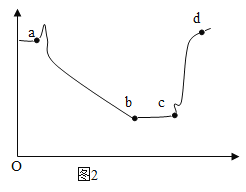
��3��ab ��ѹǿ����仯��������ͼ��ʾ��ԭ���ǣ�д��Ӧ�Ļ�ѧ����ʽ����_______________��
��4��bc ��ѹǿ���䣬ԭ����_______________��
��5��cd ��ѹǿ�����û�ѧ����ʽ����_________________��