题目内容
【题目】氢化钙(CaH2)固体是登山队员常用的能源提供剂,用它与水反应生成氢氧化钙和氢气,氢气供燃烧之需。现有84g氢化钙与足量水反应,可生成多少克H2?在标况下,这些H2的体积是多少?(H2的密度在标况下为0.09g/L)
【答案】解:设生成H2质量为 ![]() ,
,
CaH2+2H2O═Ca(OH)2+ | 2H2↑ |
42 | 4 |
84g | x |
∴ ![]()
解得: ![]() =8g,这些H2的体积V=8g÷0.09g/L=88.9L。
=8g,这些H2的体积V=8g÷0.09g/L=88.9L。
答:生成H2质量为8g;这些H2的体积为88.9L。
【解析】根据化学方程式计算分析,利用方程式进行计算时,要先写出有关反应方程式,根据方程式量的关系找出相关物质的相对质量比,再从题中找出已知物质的质量,利用相对质量比与实际质量比相等利出比例式求解;化学方程式计算要利用质量比,给定体积要转化成质量再进行计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小兵和小东是某校化学研究性学习小组的成员,他们在查阅资料时,发现单质碳能够在高温时与金属氧化物反应得到金属单质。于是,他们用木炭与CuO进行了如下的探究活动.请你参与他们的这次活动,并解决的关问题:
【提出问题】
木碳与氧化铜反应除生成单质铜外,另一种生成物是什么?
【猜想与假设】(1)可能是CO.(2)可能是CO2 .
(1)【设计实验方案】
检验CO2的方法是(用化学方程式表示)。
(2)为了检验CO,他们设计的方案是:把小动物放在收集的气体中,观察能否存活.后经充分研究后,认为此方案不可行,其不可行的理由是。
他们在互联网上用Google收集到这样一条信息:把滤纸浸泡在磷钼酸和氯化钯的黄色混合溶液中制成的试纸遇CO立即变成蓝色,而遇CO2不变色.
(3)【实验与结论】设计的实验装置图如下: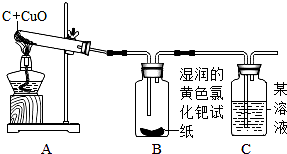
实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有生成 |
B中黄色试纸没有变蓝 | 没有生成 |
C中 | 有CO2生成 |
(4)【反思与评价】
如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是。