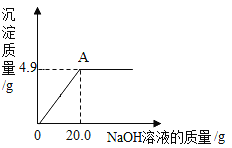
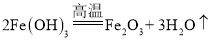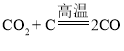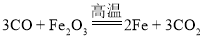题目内容
【题目】水、溶液在生产、生活中起着十分重要的作用,请根据所学知识回答问题。
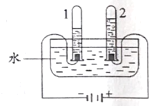
(1)氢气是理想的清洁、高能燃料。水分解可获得H2和O2。
①图中,产生氢气的试管是_____(填“1”或“2”)。
②我国开发出一种新型催化剂,实现了在光照下分解水,反应的化学方程式为_____。
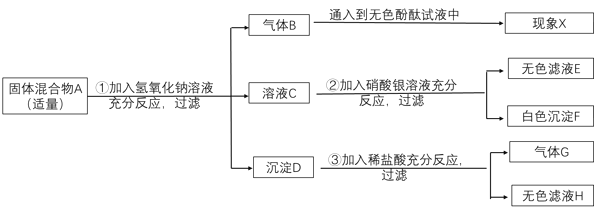
(2)粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等)。某班同学在粗盐提纯实验中,为把少量可溶性杂质Na2SO4、MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题:
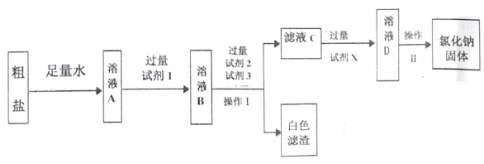
①请写出溶液A中所含的阳离子_____(用化学符号表示)。
②若试剂1是澄清石灰水,按先后顺序向溶液B加入试剂2和试剂3,则试剂2为_____。(填化学式),试剂3的作用是_____。
③请写出操作Ⅱ的名称:_____。
(3)若用所得氯化钠配制50g质量分数为6%的氯化钠溶液,需水_____mL,实验中除了用到天平、烧杯、量筒、玻璃棒等仪器外,还需用到的玻璃仪器是_____。
【答案】1 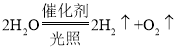 Na+、Ca2+、Mg2+ BaCl2 除去CaCl2、过量的氯化钡和氢氧化钙 蒸发结晶 47 胶头滴管
Na+、Ca2+、Mg2+ BaCl2 除去CaCl2、过量的氯化钡和氢氧化钙 蒸发结晶 47 胶头滴管
【解析】
(1)①在电解水实验中,“正氧负氢”,生成氢气和氧气的体积比约为2:1,故产生氢气的试管是1;
②水在光照和催化剂的作用下生成氢气和氧气,该反应的化学方程式为: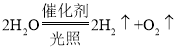 ;
;
(2)①粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等),将粗盐溶于水,溶液中含有氯化钠、氯化镁、氯化钙等,故含有的阳离子有:Na+、Ca2+、Mg2+;
②若试剂1是澄清石灰水,氢氧化钙能与氯化镁反应生成氢氧化镁和氯化钙,除去氯化镁,按先后顺序可向溶液B加入试剂2,可加入过量氯化钡,氯化钡能与硫酸钠反应生成硫酸钡白色沉淀和氯化钠,然后加入过量的试剂3碳酸钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,碳酸钠能与过量氯化钡反应生成碳酸钡和氯化钠,碳酸钠能与过量的氢氧化钙反应生成碳酸钙和氢氧化钠,故加入试剂3的目的是:除去氯化钙、过量的氯化钡和氢氧化钙;
③由图可知,溶液D经过操作Ⅱ变为氯化钠固体,故操作Ⅱ是蒸发结晶;
(3)若用所得氯化钠配制50g质量分数为6%的氯化钠溶液,,溶质质量=溶液质量×溶质质量分数=50g×6%=3g,溶剂质量=溶液质量=溶质质量=50g-3g=47g,即47mL;
用固体配制一定溶质质量分数的溶液,所需仪器:称量(药匙、托盘天平)、量取(量筒、胶头滴管)、溶解(烧杯、玻璃棒),故还需要用到的玻璃仪器是:胶头滴管。