题目内容
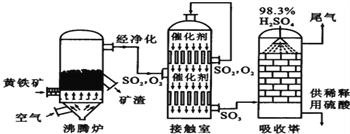
【题目】以黄铁矿为原料生产硫酸的工艺流程图如下,请回答下列问题。
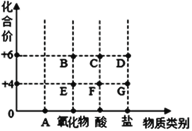
(1)在SO2、SO3、O2、H2SO4四种物质中属于氧化物的是___。
(2)在沸腾炉中发生反应的化学方程式为4___ +11O2=2Fe2O3+8SO2
(3)在接触室内化合价发生变化的元素是___。
(4)若有2000kg进入到吸收塔中,且完全被吸收,则所得的硫酸的质量是___。(已知:吸收塔内发生的化学反应是SO3+H2O=H2SO4)
【答案】SO2、SO3FeS2S和O2450kg
【解析】
(1)由不同元素组成的纯净物叫化合物;由两种元素组成,且其中一种是氧的化合物叫氧化物,在SO2、SO3、O2、H2SO4四种物质中属于氧化物的是SO2、SO3。(2)据质量守恒定律可知,反应前后原子的种类、个数不变,在沸腾炉中发生反应的化学方程式为4 FeS2+11O2=2Fe2O3+8SO2;(3)单质中元素的化合价为零,化合物中元素的化合价代数和为零。氧气中氧元素的化合价为零,化合物中氧的化合价为-2价;三氧化硫中硫的化合价为+6价,二氧化硫硫的化合价为+4价,在接触室内化合价发生变化的元素是硫和氧;(4)若有2000kg三氧化硫进入到吸收塔中,且完全被吸收,设所得的硫酸的质量是x
SO3 + H2O = H2SO4
80 98
2000kg x
80/2000kg=98/x x=2450kg。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目