题目内容
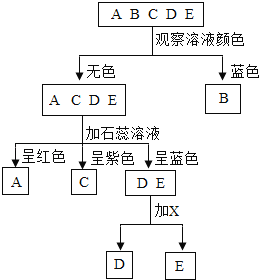
【题目】现有 A、B、C、D、E 五种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液、氯化钠溶液和稀硫酸中的一种。鉴别它们可按如图所示的步骤进行,回答下列问题:
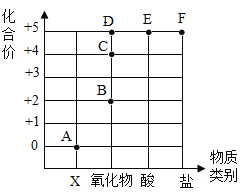
(1)溶液 A、B、C 中的溶质分别是 A_____B_____C_____(填化学式)
(2)用 X 鉴别 D、E 时,X 可以选用不同的物质。
①若X为稀盐酸,写出有气体生成的反应的化学方程式_____;
②若X为氯化钙溶液,写出有沉淀生成的反应的化学方程式_____。
【答案】H2SO4 CuSO4 NaCl Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+CaCl2=2NaCl+CaCO3↓
【解析】
硫酸铜溶液为蓝色,则B溶液是硫酸铜;稀硫酸遇石蕊变红,则A溶液是稀硫酸;氯化钠不能使石蕊变色,仍是紫色,则C溶液是氯化钠;剩余的氢氧化钠溶液和碳酸钠溶液都显碱性,能使石蕊变蓝;
(1)硫酸铜溶液为蓝色,则B溶液是硫酸铜(CuSO4);稀硫酸与石蕊变红,则A溶液是稀硫酸(H2SO4);氯化钠与石蕊是紫色,则C溶液是氯化钠(NaCl);
(2)用 X 鉴别 氢氧化钠和碳酸钠时,X 可以选用不同的物质。
①若 X 为稀盐酸,则碳酸钠能与稀盐酸反应产生氯化钠、水和二氧化碳气体的化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
②若 X 为氯化钙溶液,则碳酸钠能与氯化钙反应产生碳酸钙沉淀和氯化钠的化学方程式:Na2CO3+CaCl2=2NaCl+CaCO3↓。

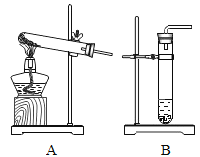
【题目】我校兴趣小组进行木炭、一氧化碳与氧化铜反应的探究实验,回答相关问题。
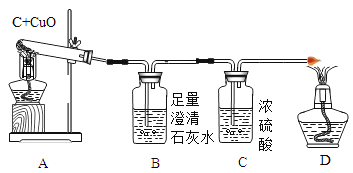
实验一:如图实验进行碳还原氧化铜实验,
(查阅资料)
(1)氧化亚铜(Cu2O) 是红色固体,能与稀硫酸发生如下反应: ![]() 。
。
(提出问题)已知实验后试管中的红色固体含有单质铜,是否还含有氧化亚铜(Cu2O) 呢?
(实验验证)取试管中的红色固体少量于试管中,加入_________溶液,试管中出现__________,证明固体中确实含有Cu2O。
(2)从定量计算角度判断测定表格中的四个数据:①若只有CO2生成,理论上m4- m3______m1-m2(选填“>”、“<”或“=”),A中发生反应的化学方程式是_____________,实际上生成的气体还有CO,分析产生CO的可能原因(写一个)__________________。
反应前的质量 | 反应后的质量 | |
装置A | m1 | m2 |
装置B | m3 | m4 |
②实验结束时先拔掉A处试管口的橡皮塞,再停止对试管加热,其目的是________________。
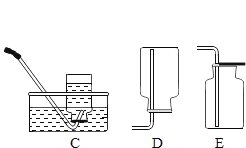
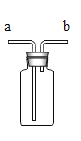
实验二:同学们对另一份氧化铜样品中氧化铜的含量进行测定。他们称取了20g固体氧化铜样品,用图1所示的装置进行实验,至反应完全(杂质不参与反应,石灰水足量),测定的部分数据如图2所示:
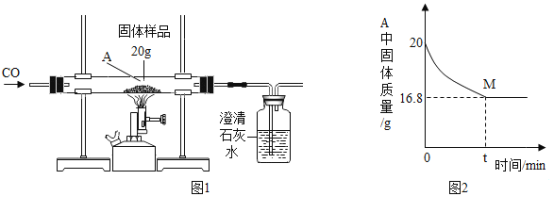
(1)澄清石灰水的作用是________________。
(2)有同学认为图1装置不够完善,为了防止尾气对空气的污染,应该把图1装置中的盛有澄清石灰水的装置换成下列____________装置(填字母序号)。
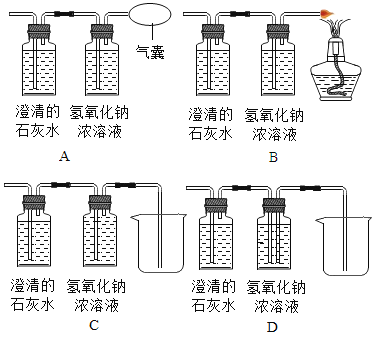
(3)用补救后的装置进行此实验,加热前先通一会儿一氧化碳的目的是________________。
(4)图2中M点的含义是________________。
(5)该样品中氧化铜的质量分数为________________。
(6)本实验中其他条件不变,只把CO换为H2进行实验,所得氧化铜样品中氧化铜的质量分数为_________(填“相同”或“不相同”)。