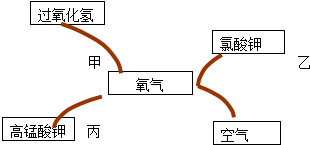
题目内容
10.我市石灰石资源丰富,某校化学兴趣小组同学为了了解某石灰石(主要成分碳酸钙)含量,取10g石灰石(杂质不参加反应,也不溶于水)放入100g稀盐酸中,恰好完全反应,反应后质量减少3.52g,计算石灰石中碳酸钙的质量分数.(已知:2HCl+CaCO3═CaCl2+H2O+CO2↑)分析 由于反应放出气体二氧化碳,因此造成反应后物质质量减小,利用质量质量守恒定律,求出反应放出二氧化碳质量;根据反应的化学方程式,由二氧化碳气体的质量求出反应反应的碳酸钙质量.
解答 解:由题意可知:生成CO2的质量:3.52g;
设反应的碳酸钙质量是x,反应生成的氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.52g
$\frac{100}{x}=\frac{44}{3.52g}$
x=8g
石灰石中碳酸钙的质量分数=$\frac{8g}{10g}×$100%=80%.
点评 此题是对化学方程式计算的考查,解题的关键是要知道反应后物质的减少量是生成二氧化碳的质量.

练习册系列答案
相关题目
18.下列关于溶液组成的说法正确的是( )
| A. | 溶质一定是固体 | |
| B. | 溶剂一定是水 | |
| C. | 溶液一定是混合物 | |
| D. | 溶液的体积等于溶质与溶剂的体积之和 |
5.下列说法违背质量守恒定律的是( )
| A. | 化学反应前后元素种类不变 | |
| B. | 化学反应前后各原子的数目不变 | |
| C. | 1gC在1gO2中充分燃烧生成2gCO2 | |
| D. | 铁在氧气中燃烧,生成物的质量大于铁的质量 |
2.开发氢能源是实现社会可持续发展的需要.工业上可用煅烧黄铁矿(主要成分FeS2)产生的二氧化硫通过下列工艺过程制取氢气.下列关于该流程说法错误的是( )
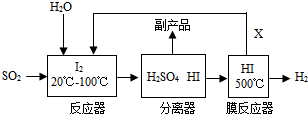

| A. | 采用该流程可减少二氧化硫对大气的污染 | |
| B. | 膜反应器中发生了置换反应 | |
| C. | 分离器中分离出的副产品是硫酸和HI | |
| D. | 生产流程中能被循环利用的物质X是I2 |
20.下列变化中,属于分解反应的是( )
| A. | 铁在氧气中燃烧 | B. | 加热高锰酸钾 | C. | 蜡烛燃烧 | D. | 在空气中加热铜 |
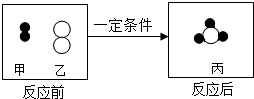 物质都是由粒子构成的,化学反应的实质是粒子之间的重新组合.如图为甲、乙两种不同的气态物质在一定条件下反应生成丙物质的微观示意图.其中其中●和○分别表示氢原子和氮原子,请据图回答:
物质都是由粒子构成的,化学反应的实质是粒子之间的重新组合.如图为甲、乙两种不同的气态物质在一定条件下反应生成丙物质的微观示意图.其中其中●和○分别表示氢原子和氮原子,请据图回答: