题目内容
把K2SO4和K2CO3的固体混合物投入173.2g稀硫酸中,恰好完全反应,得气体4.4g.将所得溶液冷却至t℃,恰好成为该温度下的K2SO4饱和溶液,测得溶液里溶质K2SO4中所含钾元素的质量为15.6g.求:
(1)原固体混合物中K2CO3的质量.
(2)反应后所得溶液的溶质质量分数.
解:设生成4.4g的二氧化碳气体需要的碳酸钾质量为x,生成的硫酸钾质量为y,
K2CO3+H2SO4=K2SO4+CO2↑+H2O
138 174 44
x y 4.4g
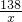 =
=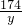 =
=
x=13.8g
y=17.4g
溶液中的硫酸钾为: 15.6=34.8g,
15.6=34.8g,
混合物中的硫酸钾为:34.8-17.4=17.4g,
硫酸钾溶液质量为:17.4+13.8+173.2-4.4=200g,
所以硫酸钾溶液质量分数为: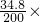 100%=17.4%
100%=17.4%
答:原固体混合物中K2CO3的质量为13.8克,反应后所得溶液的溶质质量分数为17.4%.
分析:(1)根据碳酸钾和硫酸反应会生成二氧化碳气体,依据二氧化碳的量结合比例关系进行分析;
(2)根据质量守恒定律分析反应后的溶液质量,依据钾元素的质量分数解答硫酸钾的质量.
点评:在解此类题时,首先分析题中的反应原理和需要解答的数据,然后根据方程式中的等量关系解出需要的数据在结合问题解答.
K2CO3+H2SO4=K2SO4+CO2↑+H2O
138 174 44
x y 4.4g
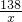 =
=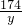 =
=
x=13.8g
y=17.4g
溶液中的硫酸钾为:
 15.6=34.8g,
15.6=34.8g,混合物中的硫酸钾为:34.8-17.4=17.4g,
硫酸钾溶液质量为:17.4+13.8+173.2-4.4=200g,
所以硫酸钾溶液质量分数为:
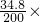 100%=17.4%
100%=17.4%答:原固体混合物中K2CO3的质量为13.8克,反应后所得溶液的溶质质量分数为17.4%.
分析:(1)根据碳酸钾和硫酸反应会生成二氧化碳气体,依据二氧化碳的量结合比例关系进行分析;
(2)根据质量守恒定律分析反应后的溶液质量,依据钾元素的质量分数解答硫酸钾的质量.
点评:在解此类题时,首先分析题中的反应原理和需要解答的数据,然后根据方程式中的等量关系解出需要的数据在结合问题解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目