题目内容
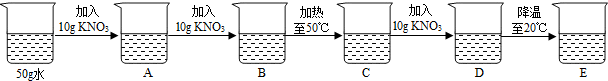
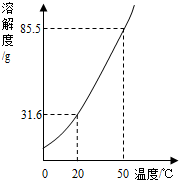
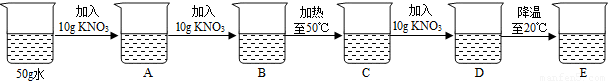
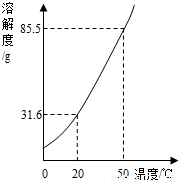
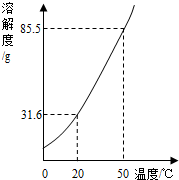
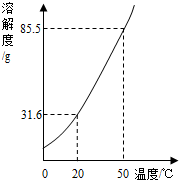
如图是KNO3的溶解度曲线,A,B,C代表KNO3三种不同状态下的溶液,请回答:
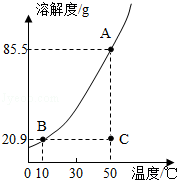
(1)A,B,C中,属于不饱和溶液的是 ,溶质质量分数最大的溶液是 .
(2)将C点溶液转化为B点溶液时,溶液温度应该降至 ℃.
(3)保持溶剂质量不变,将18.55gA点溶液降温至10℃,可析出KNO3 g.
(4)NaCl在不同温度时的溶解度如下:
|
温度/℃ |
0 |
30 |
60 |
90 |
|
溶解度/g |
35.7 |
36.3 |
37.3 |
39.0 |
25℃时,将含KNO3,NaCl各40g的固体混合物投入盛有100g水的烧杯中,充分搅拌,再加热至50℃(溶剂质量保持不变),最终烧杯中剩余的固体成分是 .
(1)C;A;(2)10;(3)6.46g;(4)NaCl.
【解析】
试题分析:(1)A,B,C中,只有C点位于溶解度曲线下方,属于不饱和溶液;由饱和溶液溶质的质量分数计算式可知:溶解度越大质量分数也就越大,所以此时溶液的质量分数最大的是A;
(2)BC两点表示溶液中溶解的溶质的质量相等,B点表示饱和溶液,将C点溶液转化为B点溶液时,应该降温至10℃恰好饱和;
(3)A点的溶解度是85.5g,10℃时B点的溶解度是20.9g,设保持溶剂质量不变,将18.55gA点溶液降温至10℃,可析出KNO3的质量为x,则有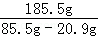 =
=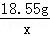 ,解得x=6.46g;
,解得x=6.46g;
(4)由图表和溶解度曲线可知:25℃时,将含KNO3,NaCl各40g的固体混合物投入盛有100g水的烧杯中,充分搅拌,固体都不能全部溶解,再加热至50℃(溶剂质量保持不变),50℃时KNO3的溶解度是85.5g,NaCl的溶解度<37.3g,因为其溶解度随温度的升高略微增大,所以此时KNO3可全部溶解,而NaCl不能全部溶解,故最终烧杯中剩余的固体成分是NaCl
考点:固体溶解度曲线及其作用;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;晶体和结晶的概念与现象;溶质的质量分数、溶解性和溶解度的关系.
点评:本题对于溶解度、溶解度曲线、溶质的质量分数的相关知识进行了较为细致的考查,能很好考查出学生对知识的掌握及对溶解度曲线、图表的分析,及解决问题的能力.

 (1)A、B中分别可以观察到什么现象?
(1)A、B中分别可以观察到什么现象? (2010?三明)请回答下列问题:
(2010?三明)请回答下列问题: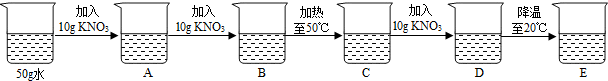
 (1)A、B中分别可以观察到什么现象?
(1)A、B中分别可以观察到什么现象?