题目内容
【题目】根据题意回答。
①写出仪器名称:a , b;
②实验室用氯酸钾和二氧化锰的混合物制取氧气,可选择的一组装置是(填编号)写出反应的化学方程式;
③下图是检查装置气密性的过程。最终在F处观察到的现象是(选填“甲~丁”);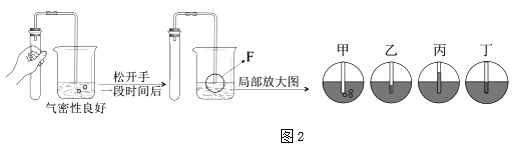
④ 资料表明:高铁酸钾(K2FeO4)固体也能用于制取氧气,原理如下:
方案一:4K2FeO4 ![]() 2Fe2O3+4K2O+3O2↑
2Fe2O3+4K2O+3O2↑
方案二:4K2FeO4+10H2O→4Fe(OH)3↓+8KOH+3O2↑
Ⅰ.关于以上方案说法错误的是
a.方案一是分解反应
b.方案二更节能简便
c.方案一、二均可在图1的装置B中进行实验
d.制取等质量的氧气,两种方案所需高铁酸钾的质量相等
Ⅱ.若用方案一(4K2FeO4 ![]() 2Fe2O3+4K2O+3O2↑)制取0.3mol氧气,需要高铁酸钾的物质的量为 mol(根据化学方程式列式计算)。
2Fe2O3+4K2O+3O2↑)制取0.3mol氧气,需要高铁酸钾的物质的量为 mol(根据化学方程式列式计算)。
【答案】酒精灯;导管;A、C;2KClO3 ![]() 2KCl+3O2↑;丙;c;0.4
2KCl+3O2↑;丙;c;0.4
【解析】①标号仪器分别是酒精灯和导管;
②氯酸钾和二氧化锰都是固体,反应条件是加热,发生装置选择A,氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
③甲、松开双手后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,该图示错误.
乙、松开双手后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,该图示错误.
丙、松开双手后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,该图示正确.
丁、松开双手后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,该图示错误.
故选:丙.
④A、由方案一:4K2FeO4![]() 2Fe2O3+4K2O+3O2↑可知,属于分解反应,故正确;
2Fe2O3+4K2O+3O2↑可知,属于分解反应,故正确;
B、方案一需加热,方案二常温进行反应,方案二更节能简便,故正确;
C、方案一需加热,属于固固加热型,不能在图1的装置B中进行实验,故错误;
D、由方案一:4K2FeO4![]() 2Fe2O3+4K2O+3O2↑和方案二:4K2FeO4+10H2O→4Fe(OH)3↓+8KOH+3O2↑可知:制取等质量的氧气,两种方案所需高铁酸钾的质量相等.
2Fe2O3+4K2O+3O2↑和方案二:4K2FeO4+10H2O→4Fe(OH)3↓+8KOH+3O2↑可知:制取等质量的氧气,两种方案所需高铁酸钾的质量相等.
设需高铁酸钾的物质的量为x mol
4K2FeO4![]() 2Fe2O3+4K2O+3O2↑
2Fe2O3+4K2O+3O2↑
4 3
x 0.3mol![]() =
=![]()
x=0.4mol
故答案为:酒精灯;导管;AC或AE;2KClO3![]() 2KCl+3O2↑;丙;c;0.4mol.
2KCl+3O2↑;丙;c;0.4mol.
①根据常用仪器的名称解答即可;
②氯酸钾在二氧化锰催化作用下加热生成氯化钾和氧气,根据反应物的状态和反应条件可选择发生装置,根据氧气的密度以及溶于水的程度可选择收集装置;
③检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;松开双手后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱;
④根据高铁酸钾受热分解、与水反应的化学方程式进行分析;根据质量守恒定律来分析;写出高铁酸钾加热生成氧气的化学反应方程式,然后结合氧气的量即可求出需要高铁酸钾的物质的量.


