题目内容
【题目】已知空气的主要成分是氮气和氧气.某课外活动小组设计了测定空气中氧气含量的实验,实验装置如图所示.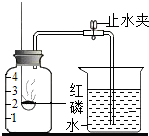
(1)该实验中,红磷需稍过量,目的是: . 写出该实验中发生的化学反应方程式 .
(2)造成测得的氧气体积分数偏小的一种原因是 .
(3)若将红磷换成炭粉,并在集气瓶中用足量氢氧化钠溶液吸收生成的气体,该实验能否获得成功?(填“能”或“否”).理由是: .
【答案】
(1)耗尽氧气,4P+5O2 ![]() 2P2O5
2P2O5
(2)红磷不足(或气密性差或未冷却到室温就观察现象)
(3)能,NaOH溶液吸收CO2使气体体积减小,也可使瓶内气压减小
【解析】解:(1)红磷燃烧的化学方程式是:4P+5O2 ![]() 2P2O5;该实验是为了测定空气中氧气的体积分数,所以需将集气瓶内的氧气充分消耗掉,所以红磷要过量;(2)造成测得的氧气体积分数偏小的一种原因是:红磷不足(或气密性差或未冷却到室温就观察现象);(3)若将红磷换成炭粉,并在集气瓶中用足量氢氧化钠溶液吸收生成的气体,该实验能获得成功,因为炭粉燃烧消耗氧气,同时生成二氧化碳气体,NaOH溶液吸收CO2使气体体积减小,也可使瓶内气压减小.
2P2O5;该实验是为了测定空气中氧气的体积分数,所以需将集气瓶内的氧气充分消耗掉,所以红磷要过量;(2)造成测得的氧气体积分数偏小的一种原因是:红磷不足(或气密性差或未冷却到室温就观察现象);(3)若将红磷换成炭粉,并在集气瓶中用足量氢氧化钠溶液吸收生成的气体,该实验能获得成功,因为炭粉燃烧消耗氧气,同时生成二氧化碳气体,NaOH溶液吸收CO2使气体体积减小,也可使瓶内气压减小.
故答案为:(1)耗尽氧气; 4P+5O2 ![]() 2P2O5;(2)红磷不足(或气密性差或未冷却到室温就观察现象);(3)能; NaOH溶液吸收CO2使气体体积减小,也可使瓶内气压减小.
2P2O5;(2)红磷不足(或气密性差或未冷却到室温就观察现象);(3)能; NaOH溶液吸收CO2使气体体积减小,也可使瓶内气压减小.
本题主要考察空气中氧气含量的测定,该实验要求装置气密性较好,反应物必须过量。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目