题目内容
【题目】据图回答下列问题

(1)写出装置图中标有a、b符号的仪器名称:a___________,b___________。
(2)实验室用双氧水制取氧气时,可选用的发生装置是_____(填序号),写出该反应的化学表达式______________;用高锰酸钾制取氧气时可选用的发生装置是____(填序号),写出该反应的化学表达式_______;写出另外一种制备氧气的化学表达式 __________,该反应中二氧化锰的作用是___________;氧气可用______________(填序号)收集。
(3)通过查阅资料得知:①氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;②氨气在加热条件下能与氧化铜反应生成铜、水和空气中含量最多气体。小芳同学加热氯化铵和氢氧化钙的固体混合物制取氨气,她应该选择的发生装置是____________;收集装置是 ________填字母编号)。收集到气体的集气瓶要_________放在桌上。
【答案】试管 集气瓶 B H2O2![]() H2O+O2 A KMnO4
H2O+O2 A KMnO4 ![]() K2MnO4+MnO2+O2 KClO3
K2MnO4+MnO2+O2 KClO3![]() KCl+O2 催化作用 C或D A E 倒
KCl+O2 催化作用 C或D A E 倒
【解析】
(1)a是试管,b是集气瓶;
(2)实验室用双氧水制取氧气,反应物的状态是固体与液体,不需要加热,属于固—液不加热型,可选用的发生装置是B;过氧化氢在二氧化锰催化作用下分解生成水和氧气,该反应的化学方程式为:H2O2![]() H2O+O2;用高锰酸钾制取氧气,反应物的状态是固体,反应条件需要加热,属于固体加热型,可选用的发生装置是A;高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为:KMnO4
H2O+O2;用高锰酸钾制取氧气,反应物的状态是固体,反应条件需要加热,属于固体加热型,可选用的发生装置是A;高锰酸钾加热分解生成锰酸钾、二氧化锰和氧气,该反应的化学方程式为:KMnO4 ![]() K2MnO4+MnO2+O2;还可以利用氯酸钾和二氧化锰制取氧气,氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,反应的化学方程式为:KClO3
K2MnO4+MnO2+O2;还可以利用氯酸钾和二氧化锰制取氧气,氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,反应的化学方程式为:KClO3![]() KCl+O2,该反应中二氧化锰的作用是催化作用;
KCl+O2,该反应中二氧化锰的作用是催化作用;
因为氧气的密度比空气大,可以用向上排空气法收集,即用D装置收集,氧气不易溶于水,可以用排水法收集,即用C装置收集,所以收集氧气可用C或D;
(3)根据“加热氯化铵和氢氧化钙的固体混合物制取氨气”可知,反应物的状态是固体,反应条件需要加热,属于固体加热型,应该选择的发生装置是A;氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用E装置收集;由于氨气密度比空气小,因此收集到氨气的集气瓶要倒放在桌上。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案【题目】氧气是我们身边无法离开的物质。请结合下图回答问题:
Ⅰ.空气中氧气含量测定再认识:
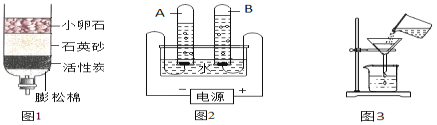
(1)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图1),写出红磷燃烧的化学方程式_______,该反应的现象为_________。燃烧结束后冷却至室温,打开止水夹观察到的现象为__________。
(2)兴趣小组用该方法测出的氧气含量常常远低于理论值,可能的原因有:①装置漏气;②________,装置内氧气有剩余;
(3)小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图2),通过7天测得的数据计算空气中氧气的含量为19.13%。与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点是:_______。
(4)为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图3),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量_________(计算结果保留一位小数)
Ⅱ.氧气的制备:

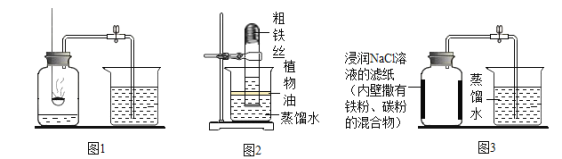
(1)写出如图中有标号仪器的名称:①__________; ② _________________。
(2)用高锰酸钾制取氧气的化学方程式_____________;用该装置作为发生装置时有一明显错误是___________。
(3)用氯酸钾和二氧化锰制备氧气时,利用下列流程分离并回收充分反应后的剩余固体,回答下列问题(氯化钾可溶于水,二氧化锰难溶于水)。

①操作m的名称是________;操作m和操作n中都用到的玻璃仪器是______,操作m中该仪器的作用是_____________。
②在分离并回收到剩余固体的过程中需要控制水的用量,原因有_____(填字母序号)。
A.提高实验效率 B.保证剩余固体全部溶解 C.节约能源
③若测得回收到的氯化钾固体质量比理论值小,原因可能是________。
A.氯化钾没有完全溶解即过滤 B.过滤时液面高于滤纸边缘
C.器皿上粘有的氯化钾没有全部转移到称量纸上
Ⅲ.氧气的收集:
某兴趣小组为了研究用向上排空气法和排水法收集的氧气浓度是否有差异,做了如下实验:加热高锰酸钾固体,分别用两种方法各收集三瓶氧气,井使用传感器测定收集到的氧气浓度,数据见表。
收集方法 | 向上排空气法 | 排水集气法 | ||||
氧气浓度% | 79.6 | 79.7 | 79.9 | 90.0 | 89.8 | 89.3 |
氧气平均浓度% | 79.7 | 89.7 | ||||
(1)小柯用向上排空气法收集氧气时,以能使放置在集气瓶瓶口的带火星木条复燃为氧气集满的标准;用排水集气法收集氧气时,以观察到______________为氧气集满的标准。
(2)以上两种方法中,用__________法收集到的氧气更纯净。
(3)不考虑操作因素,排水集气法获得的氧气体积分数不能达到100%的主要原因是___________。
(4)向上排空气法收集到的氧气浓度只有80%左右的原因有________(填字母序号)。
A.氧气的密度略大于空气的密度
B.加热高锰酸钾固体产生氧气的浓度只有80%左右
C.当观察到带火星木条复燃时,集气瓶内还有空气
D.当氧气进入集气瓶时,瓶内空气与进入的氧气相互扩散
Ⅳ.氧气的性质:
(1)铁丝在氧气中的燃烧的化学方程式___________。实验时集气瓶底部要放少量水或细沙的目的是_____________。
(2)镁带燃烧的化学方程式__________,该反应类型为__________。
【题目】化学使世界更美好,通过学习,我们有很多的收获。
收获一:世界万物都是由元素组成的,请用适当的化学符号填空:
(1)正三价的铝元素__________
(2)硝酸钾中的原子团__________
(3)人体中含量最多的物质___________
(4)植物光合作用的原料__________
(5)海水中除了水之外,含量最丰富的物质是___________
收获二:我们学会了从宏观和微观的角度认识物质世界。
(1)在水、铜和氦气三种物质中,__________(填化学式)是由原子直接构成;
(2)“![]() ”和“
”和“![]() ”表示不同元素的原子,以下图表示单质的是__________(选填编号);
”表示不同元素的原子,以下图表示单质的是__________(选填编号);

(3)食品中常加入防腐剂——苯甲酸钠(C6H5COONa)。该防腐剂由_______种元素组成,摩尔质量为____________,0.5mol的苯甲酸钠中约含有______________个氧原子
收获三:生活中处处有化学,“家”就是一个化学小世界,蕴含丰富的化学知识。
(1)某矿泉水的主要矿物质成分及含量如下表:
成分 | Ca | K | Zn | F |
含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
这里Ca、K、Zn、F是指_________(选填“元素、原子、单质”)。
(2)下表为几种家用清洁剂的功能及有效成分:
名称 | 洁厕灵 | 活氧彩漂 | 漂白精 |
功能 | 有效清除污垢与异味 | 漂洗使衣物色彩鲜艳 | 快速漂除衣物污渍 |
有效成分 | HCl | H2O2 | NaClO |
Ⅰ.这些清洁剂属于__________(选填“混合物”或“纯净物”),若不小心把“洁厕灵”打翻在大理石地面上,会出现______________________的现象;
Ⅱ.![]() 中氢、氧元素质量比为___________
中氢、氧元素质量比为___________
Ⅲ.“洁厕灵”与“漂白精”不能混用,二者混合易产生一种有毒气体X。反应原理为:NaClO+2HCl→NaCl+X↑+H2O,则X的化学式为_________。
(3)玻璃中的主要成分![]() 属于______________(选填“金属氧化物”或“非金属氧化物”)
属于______________(选填“金属氧化物”或“非金属氧化物”)
(4)塑料诞生一百年来风光无限,它的发明者贝克兰也因此荣获“塑料之父”的美誉,而今由于人们使用不当而直接引发的一大环境问题是______________(填选编号)。
A.沙尘暴 B.水土流失 C.温室效应 D.白色污染
(5)天然气的主要成分是甲烷(CH4)一个甲烷分子的质量约为_______________克(只列式,不用计算结果)