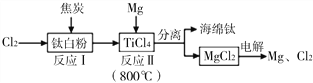
题目内容
【题目】某兴趣小组利用下列实验装置,开展O2、CO2的实验室制取和有关性质的研究。
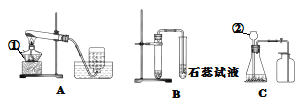
(1)写出A、C装置编号仪器的名称: ①______________;②______________。
(2)甲同学用稀盐酸和大理石在B装置中反应,该反应的化学方程式为_______,观察到试管中紫色石蕊试液________________(填现象)。
(3)乙同学要用KMnO4固体来制取O2,应选用上图中的_________装置(填字母),该反应的化学方程式为__________________;在完成“氧气的制取与性质”的基础实验后,他还想进行蜡烛在不同浓度的氧气中燃烧情况的探究,现要较简便地获得两瓶不同浓度的氧气,应选择收集氧气的方法是______________。
(4)把干燥纯净的KClO3和MnO2的混合物3.45g装入大试管中,加热制取O2,待反应完全后,将试管冷却,得到2.49g固体物质。试计算混合物中MnO2的质量。
【答案】 酒精灯 长颈漏斗 CaCO3+2HClCaCl2+H2O+CO2↑ 变红 A 2KMnO4![]() K2MnO4+MnO2+O2↑ 向上排空气法 1g
K2MnO4+MnO2+O2↑ 向上排空气法 1g
【解析】(1)①是酒精灯,②是长颈漏斗。(2)大理石的主要成分是碳酸钙,与稀盐酸反应,生成氯化钙、水、二氧化碳。二氧化碳能使紫色的石蕊溶液变红。(3)加热固体制取氧气,选择发生装置 A ,反应的化学方程式是:2KMnO4![]() K2MnO4+MnO2+O2↑,要较简便地获得两瓶不同浓度的氧气,用向上排空气法收集气体,可得到不同浓度的氧气。(4)加热KClO3和MnO2的混合物,生成的氧气由导气管导出,固体减少的质量是生成氧气的质量,故生成氧气的质量为:3.45g-2.49g=0.96g.,设混合物中KClO3的质量为x,
K2MnO4+MnO2+O2↑,要较简便地获得两瓶不同浓度的氧气,用向上排空气法收集气体,可得到不同浓度的氧气。(4)加热KClO3和MnO2的混合物,生成的氧气由导气管导出,固体减少的质量是生成氧气的质量,故生成氧气的质量为:3.45g-2.49g=0.96g.,设混合物中KClO3的质量为x,
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
245 96
x 0.96g
![]() =
=![]() 解得x=2.45g
解得x=2.45g
混合物中MnO2的质量为:3.45g-2.45g=1g

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案