题目内容
(5分)自来水厂常用氯气杀菌消毒,用明矾、氯化铁等絮凝剂净化水。以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3?6H2O)的工艺流程如下:
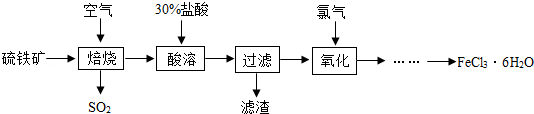
回答下列问题:
⑴实验室过滤操作中玻璃棒的作用是___________。
⑵流程中需用30%的盐酸“酸溶”焙烧后的残渣。若要配制7.4吨质量分数为30%的盐酸,需要质量分数为37%的浓盐酸_________吨,由浓溶液配制稀溶液时,计算的依据是____________________________。
⑶二氧化硫能形成酸雨,危害环境。常用下列方法除去:
方法1.将含二氧化硫的废气通入氨水中吸收二氧化硫。氨水的pH______7(填写“>”“=”或“<”)。
方法2.将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫。写出反应的化学方程式:_____________。

回答下列问题:
⑴实验室过滤操作中玻璃棒的作用是___________。
⑵流程中需用30%的盐酸“酸溶”焙烧后的残渣。若要配制7.4吨质量分数为30%的盐酸,需要质量分数为37%的浓盐酸_________吨,由浓溶液配制稀溶液时,计算的依据是____________________________。
⑶二氧化硫能形成酸雨,危害环境。常用下列方法除去:
方法1.将含二氧化硫的废气通入氨水中吸收二氧化硫。氨水的pH______7(填写“>”“=”或“<”)。
方法2.将含有二氧化硫的废气通入石灰石悬浊液中,在空气作用下生成硫酸钙和二氧化碳,从而除去二氧化硫。写出反应的化学方程式:_____________。
⑴引流; ⑵6 ;溶液稀释前后溶质质量不变; ⑶ >; 2CaCO3+2SO2+O2=2CaSO4+2CO2
试题分析:(1)过滤时玻璃棒的作用是引流,防止冲破滤纸;(2)稀释溶液前后溶质质量不变,故设需要质量分数为37%的浓盐酸的质量为x,则7.4吨×30%=37%x 解得x=6吨;(3)氨水属于碱溶液,pH>7;由题意知,方法二的反应物为二氧化硫、碳酸钙和氧气,生成为硫酸钙和二氧化碳,正确写出化学方程式即可.

练习册系列答案
相关题目


 H2+O2
H2+O2 2P2O5
2P2O5