题目内容
【题目】实验室常用燃烧的方法测定有机物的组成。现取3.2g某有机物在足量氧气中充分燃烧,生成4.4g二氧化碳和3.6g水,则该有机物中( )
物 质 | A | B | C | D |
反应前质量/g | 20 | 12 | 2 | 6 |
反应后质量/g | 0 | 2 | 2 | 待测 |
A.一定含有C,H两种元素,可能含有O元素
B.一定含有C,O两种元素,可能含有H元素
C.只含有C,H两种元素,不含有O元素
D.一定含有C,H,O三种元素
【答案】D
【解析】根据质量守恒定律,反应后生成的二氧化碳中碳元素的质量就是有机物中碳元素的质量,生成的水中氢元素的质量就是有机物中氢元素的质量.故该有机物中含有C的质量为:4.4g×![]() =1.2g;该有机物中含有H的质量为:3.6g×
=1.2g;该有机物中含有H的质量为:3.6g×![]() =0.4g;该有机物中含有O的质量为:3.2g-1.2g-0.4g=1.6g.因此可判断该有机物中含有C、H、O三种元素.
=0.4g;该有机物中含有O的质量为:3.2g-1.2g-0.4g=1.6g.因此可判断该有机物中含有C、H、O三种元素.
所以答案是:D.
【考点精析】本题主要考查了质量守恒定律及其应用的相关知识点,需要掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏才能正确解答此题.

【题目】图表法是一种常用的数据处理方法,结合所给图表回答下列问题 氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |
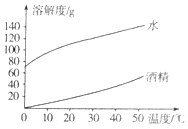
(1)上述图象表示(填“氢氧化钠”或“碳酸钠”)的溶解度曲线
(2)20℃时,氢氧化钠的溶解度(填“大于”或“小于”)碳酸钠
(3)40℃时,若将50gNaOH分别投入到100g水和100g酒精中,能形成饱和溶液的是 , 再将CO2通入所得NaOH的酒精溶液中,观察到的现象为 .