题目内容
 (2013?德州一模)根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(2013?德州一模)根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:(1)P点表示在t1℃两物质的溶解度关系为b
=
=
c(填“>”、“<”或“=”,下同).(2)将t2℃时b、c两种物质的饱和溶液降温至t1℃,两种溶液的溶质质量分数的大小关系为
b>c
b>c
.(3)t2℃时,26g b物质加入到50g水中充分溶解后,所得溶液的质量为
75g
75g
.(4)b中含有少量的a,若要提纯b,可采用
降温
降温
结晶的方法.分析:(1)根据曲线中交点的含义考虑;
(2)根据各物质溶解度曲线的变化情况结合饱和溶液质量分数的计算考虑;
(3)根据t2℃时,b物质的溶解度考虑;
(4)根据固体物质从溶液中结晶析出的方法考虑.
(2)根据各物质溶解度曲线的变化情况结合饱和溶液质量分数的计算考虑;
(3)根据t2℃时,b物质的溶解度考虑;
(4)根据固体物质从溶液中结晶析出的方法考虑.
解答:解:(1)曲线中交点表示该温度时两种物质的溶解度相等,所以P点表示在t1℃两物质的溶解度相等;
(2)t2℃时,将b、c两物质的溶解度b大于c,所以该温度下b、c的饱和溶液溶质质量分数也是b大于c;降低温度b的溶解度减小析出晶体,仍是饱和溶液,c的溶解度增大,但不会析出晶体所以溶液的溶质质量分数不变;因t1℃时b的溶解度大于t2℃时c的溶解度,根据饱和溶液中溶质质量分数公式:
×100%可知,将t2℃时b、c两种物质的饱和溶液降温至t1℃,两种溶液的溶质质量分数的大小关系为:b>c;
(3)t2℃时,b物质的溶解度是50g,即100g水中溶解50g,所以50g水中只能溶解25g,所以所得溶液质量为50g+25g=75g;
(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于b得的溶解度随着温度变化比较大,所以用降温结晶或冷却热饱和溶液的方法析出晶体.
故答案为:(1)=;(2)b>c;(3)75g;(4)降温.
(2)t2℃时,将b、c两物质的溶解度b大于c,所以该温度下b、c的饱和溶液溶质质量分数也是b大于c;降低温度b的溶解度减小析出晶体,仍是饱和溶液,c的溶解度增大,但不会析出晶体所以溶液的溶质质量分数不变;因t1℃时b的溶解度大于t2℃时c的溶解度,根据饱和溶液中溶质质量分数公式:
| 溶解度 |
| 100g+溶解度 |
(3)t2℃时,b物质的溶解度是50g,即100g水中溶解50g,所以50g水中只能溶解25g,所以所得溶液质量为50g+25g=75g;
(4)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于b得的溶解度随着温度变化比较大,所以用降温结晶或冷却热饱和溶液的方法析出晶体.
故答案为:(1)=;(2)b>c;(3)75g;(4)降温.
点评:解答本题的关键是要知道溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液溶质质量分数的计算公式,固体物质从溶液中结晶析出的方法.

练习册系列答案
相关题目
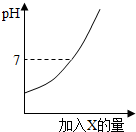 (2013?德州一模)向盐酸中加入过量某物质X,溶液的pH随加入X的量的变化关系如右下图所示.则X是( )
(2013?德州一模)向盐酸中加入过量某物质X,溶液的pH随加入X的量的变化关系如右下图所示.则X是( )