题目内容
【题目】某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究。甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象,结论:两种物质未发生反应;乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由______色变为无色,结论:两种物质发生了反应,反应的化学方程式为______。
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应,并对乙同学的实验继续探究:
(提出问题)乙同学实验后的溶液中的溶质是什么?
(提出猜想)猜想一:只有CaCl2;猜想二:有CaCl2和HCl;猜想三:有______。
(实验探究)为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验。
方案编号 | 方案1 | 方案2 |
实验操作 |
|
|
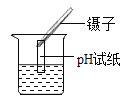
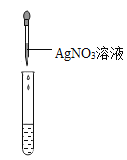
实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 |
实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
(实验评价)丙同学的2个方案都有不足之处,其中:
方案1的不足之处是:______;
方案2的不足之处是:______;
(实验拓展)若证明猜想二正确,请你再设计一个简单的实验方案![]() 包括步骤、现象、结论
包括步骤、现象、结论![]() _____。
_____。
【答案】红色 Ca(OH)2+2HCl=CaCl2+2H2O 氯化钙和氢氧化钙 将pH试纸直接伸入待测液中,污染试剂 加AgNO3产生白色沉淀只能说明溶液中有Cl-,不能说明只有氯化钙 向待测溶液中加入铁粉,若现有气体产生则证明猜想二成立
【解析】
酚酞试液遇碱性溶液显红色,所以向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由红色变为无色,说明两种物质发生了反应,其中氢氧化钙溶液和盐酸反应生成氯化钙和水,反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O;
[提出猜想]反应后的溶液中一定有氯化钙,然后考虑反应物的过量问题,或恰好完全反应,则为氯化钙;若氢氧化钙剩余,则溶质为氯化钙和氢氧化钙;若盐酸有剩余,则溶质为氯化钙和氯化氢;
[实验评价]用pH试纸测定溶液酸碱性时不能将pH试纸直接伸入待测液中,否则污染试剂,所以方案1中使用pH试纸的操作不对;方案2中加AgNO3产生白色沉淀只能说明溶液中有Cl-,不能说明只有氯化钙;
[实验拓展]根据盐酸的性质来分析可知:向待测溶液中加入铁粉,若现有气体产生则证明猜想二成立。