题目内容
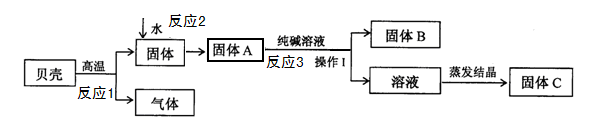
在发明电解法以前,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱。某小组同学按下图所示流程进行实验,请你参与探究并回答相关问题。
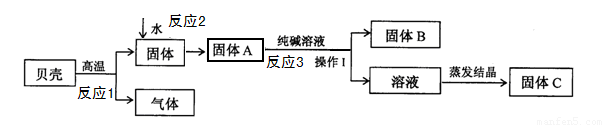
(1)反应1的化学方程式是
(2)反应3的化学方程式是 ;
(3)操作I中用到的玻璃仪器有烧杯、 、玻璃棒;
(4)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是 ;
【问题与发现】 该小组同学所得固体C一定是纯净的NaOH吗?
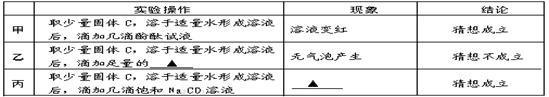
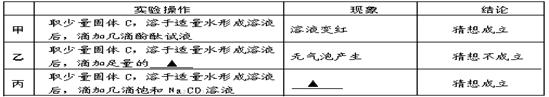
【猜想与假设】 根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH
乙:NaOH和Na2CO3的混合物
丙:NaOH和 的混合物
【探究与验证】 甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
【反思与评价】 同学们认真研究实验流程,讨论后一致认为乙、丙两同学的方案、现象和推理均正确,请你根据实验流程对甲同学设计方案进行评价: 。
(1)CaCO3 CaO+CO2↑ (2)Ca(OH)2+
Na2CO3=CaCO3↓+2NaOH
CaO+CO2↑ (2)Ca(OH)2+
Na2CO3=CaCO3↓+2NaOH
(3)漏斗;(4)关键词:防止液滴飞溅; 氢氧化钙
(5)稀盐酸;(6)溶液中生成白色沉淀;
(7)关键词: 结论不准确, 未能考虑碳酸钠溶液也呈碱性。
【解析】
试题分析:(1)根据图示可知,反应1是碳酸钙高温分解生成氧化钙和二氧化碳,故反应的化学方程式是CaCO3 CaO+CO2↑。
CaO+CO2↑。
(2)根据图示可知,反应1生成的固体氧化钙,在加入水后,反应生成氢氧化钙(反应2),而氢氧化钙能与碳酸钠反应,生成碳酸钙沉淀和氢氧化钠(反应3),故反应的化学方程式是Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH。
(3)操作I是将固体B和溶液分离,而将不溶水的固体物质与液体分离的方法是过滤,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒。
(4)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,目的是防止液体受热不均匀,造成液滴飞溅。
【猜想与假设】由于氢氧化钙与碳酸钠的反应,不一定是恰好完全反应,故反应物可能会有剩余,所以所得溶液C中除了反应生成的氢氧化钠之外,还可能含有氢氧化钙或碳酸钠。
【探究与验证】由于乙的猜想是氢氧化钠与碳酸钠,其中碳酸钠能与酸反应生成二氧化碳气体,则根据乙操作所出现的现象和结论可知,乙加入的是稀盐酸或稀硫酸;
由于丙的猜想是氢氧化钠与氢氧化钙的混合物,由于猜想成立,即说明一定含有氢氧化钙,故向其中滴加碳酸钠溶液,二者反应会生成白色沉淀(碳酸钙)。
【反思与评价】甲的设计方案不严密,在实验过程中,纯碱溶液与氢氧化钙不一定恰好完全反应,而不论剩余纯碱溶液,还是氢氧化钙溶液,均能显碱性,故无论哪种物质过量,滴加酚酞均会变红,故不能据溶液变红确定只有氢氧化钠。
考点:物质的相互转化和制备
点评:本题是一道结合实验流程图探究烧碱制备的探究题,考查了学生依据相关知识分析、解决问题的能力,对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案