题目内容
 某化工厂用侯氏制碱法制得的纯碱中含少量氯化钠.为了测定纯碱样品中碳酸钠的质量,化学兴趣小组的同学进行了以下实验:
某化工厂用侯氏制碱法制得的纯碱中含少量氯化钠.为了测定纯碱样品中碳酸钠的质量,化学兴趣小组的同学进行了以下实验:【动手实验】
①取该纯碱样品12.7g,加入150g水中,充分搅拌到完全溶解;
②向①中所得溶液里逐滴滴加某未知溶质质量分数的氯化钡溶液,观察现象,记录数据.
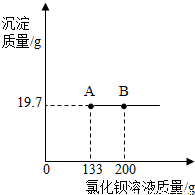
【绘制图表】如图所示,横坐标表示加入的氯化钡溶液质量,纵坐标表示生成沉淀的质量
【分析数据,计算结果】请你帮助他们回答下列问题:
(1)当滴入氯化钡溶液至图中B点时,烧杯中溶液里含有的溶质是(写化学式)
(2)该纯碱样品中碳酸钠的质量是
(3)当滴入氯化钡溶液133g时(即A点),试通过计算,求此时所得不饱和溶液中溶质的质量.
分析:根据碳酸钠和氯化钡会生成碳酸钡沉淀,结合图象中的转折点进行分析;
根据方程式中的比例关系和题中的数据解出需要的数据.
根据方程式中的比例关系和题中的数据解出需要的数据.
解答:解:(1)当氯化钡和碳酸钠接触后会生成碳酸钙沉淀和氯化钠,加入的氯化钡质量大于133克时,沉淀质量不再变化,所以A点两者恰好完全反应,B点时,氯化钡过量,含有的溶质有样品中的氯化钠、生成的氯化钠,和过量的氯化钡,故答案为:NaCl、BaCl2;
(2)从图象中可以看出加入133克的氯化钡时生成的沉淀质量是19.7克,
设生成19.7克的沉淀需要碳酸钠为x,生成氯化钠为y
Na2CO3+BaCl2=2NaCl+BaCO3↓
106 117 197
x y 19.7
=
=
x=10.6g,
y=11.7g,
故答案为:碳酸钠质量为:10.6g;
反应后的溶质质量为:12.7-10.6+11.7=13.8g,
所以反应后的溶质质量是13.8g.
(2)从图象中可以看出加入133克的氯化钡时生成的沉淀质量是19.7克,
设生成19.7克的沉淀需要碳酸钠为x,生成氯化钠为y
Na2CO3+BaCl2=2NaCl+BaCO3↓
106 117 197
x y 19.7
| 106 |
| x |
| 197 |
| 19.7 |
| 117 |
| y |
x=10.6g,
y=11.7g,
故答案为:碳酸钠质量为:10.6g;
反应后的溶质质量为:12.7-10.6+11.7=13.8g,
所以反应后的溶质质量是13.8g.
点评:在解此类题时,关键是分析题中图象中转折点的含义和方式反应的原理,再根据比例关系解答.

练习册系列答案
相关题目
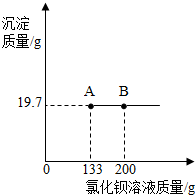 某化工厂用侯氏制碱法制得的纯碱中含少量氯化钠.为了测定纯碱样品中碳酸钠的质量,化学兴趣小组的同学进行了以下实验:
某化工厂用侯氏制碱法制得的纯碱中含少量氯化钠.为了测定纯碱样品中碳酸钠的质量,化学兴趣小组的同学进行了以下实验: