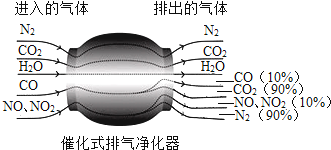
题目内容
【题目】在100 g稀盐酸中放入一定量的镁粉恰好反应完全,生成氢气0.4 g,求参加反应的金属镁的质量?该稀盐酸中溶质的质量分数是多少?
【答案】解:设镁的质量为x,氯化氢的质量为y,则
Mg + | 2HCl = MgCl2 + | H2↑ |
24 | 73 | 2 |
x | y | 0.4g |
![]()
X=4.8g y=14.6g
稀盐酸中溶质的质量分数![]() ×100%=14.6%;
×100%=14.6%;
答:参加反应的金属镁的质量是4.8g,该稀盐酸中溶质的质量分数是14.6%。
【解析】根据化学方程式进行简单计算,知道氢气的质量求出镁、氯化氢的质量,![]() 来求出稀盐酸中溶质的质量分数。
来求出稀盐酸中溶质的质量分数。
【考点精析】通过灵活运用溶质的质量分数和根据化学反应方程式的计算,掌握溶质的质量分数=(溶质质量/溶液质量)*100% = [溶质质量/(溶质质量+溶剂质量]*100%;各物质间质量比=系数×相对分子质量之比即可以解答此题.

练习册系列答案
相关题目