题目内容
19.(2009?威海)实验室里现有一瓶久置的过氧化氢消毒液,为测定其溶质的质量分数,某化学活动小组的同学做了如下实验:秤取3g二氧化锰放入烧杯中,加入100g该消毒液,反应完全后烧杯中剩余物质的总质量为99g,请计算该过氧化氢消毒液中溶质的质量分数.
【答案】分析:①过氧化氢分解反应中,二氧化锰只是催化剂,本身不参与反应.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.故生成氧气的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
②根据过氧化氢分解的化学方程式和生成的氧气的质量,列出比例式,就可计算出参与反应的H2O2质量,然后根据溶质质量分数= ×100%计算即可.
×100%计算即可.
解答:解:①生成氧气的质量为:100g+3g-99g=4g;
②设参与反应的H2O2质量为x,
2H2O2 2H2O+O2↑
2H2O+O2↑
68 32
x 4g
∴68:32=x:4g,
解之得;x=8.5g;
该过氧化氢消毒液中溶质的质量分数为: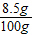 ×100%=8.5%.
×100%=8.5%.
答:该过氧化氢消毒液中溶质的质量分数为8.5%.
点评:本题主要考查学生利用质量守恒定律、化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
②根据过氧化氢分解的化学方程式和生成的氧气的质量,列出比例式,就可计算出参与反应的H2O2质量,然后根据溶质质量分数=
 ×100%计算即可.
×100%计算即可.解答:解:①生成氧气的质量为:100g+3g-99g=4g;
②设参与反应的H2O2质量为x,
2H2O2
 2H2O+O2↑
2H2O+O2↑68 32
x 4g
∴68:32=x:4g,
解之得;x=8.5g;
该过氧化氢消毒液中溶质的质量分数为:
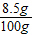 ×100%=8.5%.
×100%=8.5%.答:该过氧化氢消毒液中溶质的质量分数为8.5%.
点评:本题主要考查学生利用质量守恒定律、化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
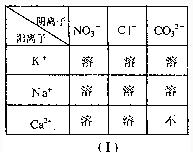
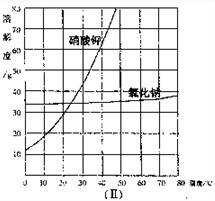
17.(2009?威海)图(Ⅰ)为“常温下部分酸、碱、盐的溶解性表”,(Ⅱ)为“硝酸钾和氯化钠在不同温度时的溶解度曲线”,阅读材料并回答问题:
过去民间燃放的鞭炮都是黑火药制成的.在制备黑火药时,硝酸钾是一种关键物质.硝酸钾俗称火硝,主要存在于硝土中(硝土的成分有硝酸钾、硝酸钙、氯化钠及一些难溶性的固体物质等).
(I)
传统的提取粗硝酸钾的过程按以下步骤进行:
(1)溶解.将硝土与豆秆灰(豆秆灰的成分中含碳酸钾及一些难溶性的固体)按一定的质量比混合,常温下加入足量的水并进行充分的搅拌.其中发生化学变化的有关反应方程式为
.
(2)接下来要进行的操作是,便可得到澄清的液体A.为了最大限度地得到硝酸钾,通常要加入稍过量的豆秆灰,如何通过实验证明加入的豆秆灰已过量?
.
(3)蒸发浓缩.将第(2)步操作中得到的液体A进行加热蒸发浓缩,析出晶体X,你认为晶体X的主要成分是什么?.理由是.若在实验室进行本操作,需要的主要仪器有.
(4)过滤.将(3)步操作中得到的混合物趁热过滤,滤出晶体X,得到溶液B.
(5)最后对滤液B进行,然后过滤,便可分离出晶体Y,晶体Y的主要成分是.

过去民间燃放的鞭炮都是黑火药制成的.在制备黑火药时,硝酸钾是一种关键物质.硝酸钾俗称火硝,主要存在于硝土中(硝土的成分有硝酸钾、硝酸钙、氯化钠及一些难溶性的固体物质等).
| 阴离子 阳离子 | NO3- | Cl- | CO32- |
| K+ | 溶 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 |
| Ca2+ | 溶 | 溶 | 不 |
传统的提取粗硝酸钾的过程按以下步骤进行:
(1)溶解.将硝土与豆秆灰(豆秆灰的成分中含碳酸钾及一些难溶性的固体)按一定的质量比混合,常温下加入足量的水并进行充分的搅拌.其中发生化学变化的有关反应方程式为
.
(2)接下来要进行的操作是,便可得到澄清的液体A.为了最大限度地得到硝酸钾,通常要加入稍过量的豆秆灰,如何通过实验证明加入的豆秆灰已过量?
.
(3)蒸发浓缩.将第(2)步操作中得到的液体A进行加热蒸发浓缩,析出晶体X,你认为晶体X的主要成分是什么?.理由是.若在实验室进行本操作,需要的主要仪器有.
(4)过滤.将(3)步操作中得到的混合物趁热过滤,滤出晶体X,得到溶液B.
(5)最后对滤液B进行,然后过滤,便可分离出晶体Y,晶体Y的主要成分是.