题目内容
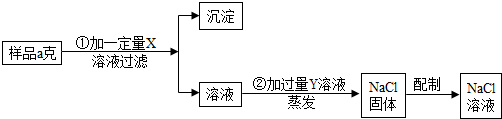
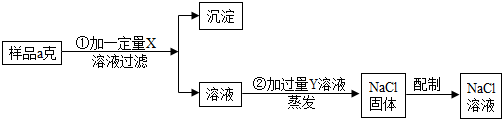
26、用含有少量CaCl2的NaCl固体,配制浓度为10%的食盐溶液.实验步骤如图:
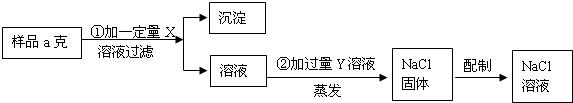
(1)加入的X为
加入的Y为
(2)若将配制好的溶液装入试剂瓶中,请你填写好标签 .
.

(1)加入的X为
Na2CO3
,发生反应的化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl
.加入的Y为
HCl
(2)若将配制好的溶液装入试剂瓶中,请你填写好标签

分析:(1)用含有少量CaCl2的NaCl固体配制食盐溶液,首先应除去混有的少量的氯化钙.除杂质最低要求不能产生新的杂质,所以除去混在氯化钠里的少量氯化钙最好选用碳酸钠溶液,既与氯化钙生成碳酸钙沉淀同时还能生成氯化钠,多余的碳酸钠还可以滴加稀盐酸轻易除去.
(2)配制好的溶液应装瓶密封保存,为识别溶液需要瓶上贴标签,说明是什么溶液、溶液的溶质量分数、溶液的配制时间及溶液配制者等信息.
(2)配制好的溶液应装瓶密封保存,为识别溶液需要瓶上贴标签,说明是什么溶液、溶液的溶质量分数、溶液的配制时间及溶液配制者等信息.
解答:解:(1)根据流程图,可以得知X是为除去氯化钙而加的,Y则是再除去过量的X而加入的,而过量的Y随蒸发而挥发.加入X不产生新杂质,再结合X能与氯化钙生成沉淀,可猜测加X和氯化钙反应后生成碳酸钙和氯化钠,所以X为碳酸钠.那么为除去多余的碳酸钠就应加入稀盐酸,所以Y就是稀盐酸.
故答:Na2CO3(名称化学式均可);CaCl2+Na2CO3=CaCO3↓+2NaCl;HCl(或写盐酸);
(2)溶液的标签至少需要标明溶液有名称和溶液的溶质质量分数.
故答:
故答:Na2CO3(名称化学式均可);CaCl2+Na2CO3=CaCO3↓+2NaCl;HCl(或写盐酸);
(2)溶液的标签至少需要标明溶液有名称和溶液的溶质质量分数.
故答:

点评:碳酸钠(Na2CO3)溶液在除杂类、鉴别类问题中有特殊的应用,因为其既能和许多金属离子形成碳酸盐沉淀,又能和酸产生气体二氧化碳.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目