题目内容
 126g溶质质量分数为10%的硝酸溶液与91g氢氧化钠溶液恰好完全反应,试计算:
126g溶质质量分数为10%的硝酸溶液与91g氢氧化钠溶液恰好完全反应,试计算:(1)生成硝酸钠
(2)原氢氧化钠溶液中溶质的质量分数是
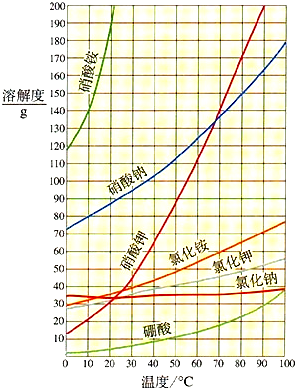
(3)根据如图分析计算,若要形成10℃时硝酸钠的饱和溶液,可用
分析:(1)根据硝酸的质量即可求出参见反应的氢氧化钠以及生成硝酸钠的质量;
(2)利用溶质质量分数的公式求出原氢氧化钠溶液中溶质的质量分数即可;
(3)根据使不饱和溶液变为饱和溶液可以采取蒸发溶剂或加溶质以及硝酸钠在10℃的溶解度为80g进行解答.
(2)利用溶质质量分数的公式求出原氢氧化钠溶液中溶质的质量分数即可;
(3)根据使不饱和溶液变为饱和溶液可以采取蒸发溶剂或加溶质以及硝酸钠在10℃的溶解度为80g进行解答.
解答:解:(1)设参见反应的氢氧化钠的质量为x,生成硝酸钠的质量为y.
NaOH+HNO3═NaNO3+H2O
40 63 85
x 126g×10% y
=
x=8g
=
y=17g
答:生成硝酸钠的质量是17克;故填:17;
(2)原氢氧化钠溶液中溶质的质量分数=
×100%=8.8%;故填:8.8%;
(3)使不饱和溶液变为饱和溶液可以采取蒸发溶剂或加溶质的方法;故填:蒸发溶剂或加溶质;
设蒸发溶剂的质量为w
原硝酸钠溶液中水的质量=126g+91g-17g=200g,由硝酸钠在10℃的溶解度为80g可知.
蒸发溶剂质量:溶质 溶剂
17g 200g-w
80g 100g
=
w=178.75g
溶液的质量为:217g-178.75g=38.3g
设加入溶质的质量为z
加溶质质量:溶质 溶剂
17g+z 200g
80g 100g
=
z=143g
溶液为:143g+217g=360g
答:饱和溶液的质量为38.3g或360g.
NaOH+HNO3═NaNO3+H2O
40 63 85
x 126g×10% y
| 40 |
| x |
| 63 |
| 126g×10% |
x=8g
| 63 |
| 126g×10% |
| 85 |
| y |
y=17g
答:生成硝酸钠的质量是17克;故填:17;
(2)原氢氧化钠溶液中溶质的质量分数=
| 8g |
| 91g |
(3)使不饱和溶液变为饱和溶液可以采取蒸发溶剂或加溶质的方法;故填:蒸发溶剂或加溶质;
设蒸发溶剂的质量为w
原硝酸钠溶液中水的质量=126g+91g-17g=200g,由硝酸钠在10℃的溶解度为80g可知.
蒸发溶剂质量:溶质 溶剂
17g 200g-w
80g 100g
| 17g |
| 80g |
| 200g-w |
| 100g |
w=178.75g
溶液的质量为:217g-178.75g=38.3g
设加入溶质的质量为z
加溶质质量:溶质 溶剂
17g+z 200g
80g 100g
| 17g+z |
| 80g |
| 200g |
| 100g |
z=143g
溶液为:143g+217g=360g
答:饱和溶液的质量为38.3g或360g.
点评:本题考查了氢氧化钠与硝酸的中和反应的有关计算,完成此题,可以依据已有的知识结合题干提供的信息进行.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
 现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:| 硫酸(500mL) 品 名 硫酸 化学式 H2SO4 相对分子质量98 密 度 1.84g/cm3 质量分数98% (1)硫酸由 氢 氢 元素、硫 硫 元素、氧 氧 元素组成,它含氧元素,它不是 不是 (是、不是)氧化物;磷酸相对分子质量为98 98 ;你认为硫酸与磷酸含氧元素质量相等的条件是硫酸和磷酸的质量相等 硫酸和磷酸的质量相等 ;(2)该试剂瓶中硫酸溶液的质量是 920 920 g.(3)工会主席王赐用20g该浓硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈.他在配制该溶液时所用98%的浓硫酸与水的质量比应该为 10:39 10:39 .(4)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量. (5)若加入的稀硫酸刚好使沉淀达最大量时,将所得混合物过滤、洗涤,得滤液并将其稀释至200g(过程中损耗忽略不计),计算该滤液中溶质的质量分数为 氯化钠的质量分数为6%,氯化氢的质量分数为3.65% 氯化钠的质量分数为6%,氯化氢的质量分数为3.65% .(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)[注:(3)、(4)两问需写出计算过程].(6)喜欢探究又善于思考的周泽坤出这样题目考大家:把30g含Fe、Al、Mg、Zn的金属粉末投入适量的稀硫酸中全部溶解完,再将溶液蒸干得无水干燥固体126g,则同时产生的氢气质量为 2 2 g;探究中泽坤发现:用相同浓度的硫酸,与一瓶未变质、部分变质、全变质(杂质都是氢氧化钙)的生石灰样品反应,需要的硫酸质量都相等,其原因是氧化钙和碳酸钙都是每40g钙元素生成136g硫酸钙,消耗98g硫酸 氧化钙和碳酸钙都是每40g钙元素生成136g硫酸钙,消耗98g硫酸 .
|
| 硫酸(500mL) 品 名 硫酸 化学式 H2SO4 相对分子质量98 密 度 1.84g/cm3 质量分数98% |
(2)该试剂瓶中硫酸溶液的质量是________g.
(3)工会主席王赐用20g该浓硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈.他在配制该溶液时所用98%的浓硫酸与水的质量比应该为________.
(4)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量.
(5)若加入的稀硫酸刚好使沉淀达最大量时,将所得混合物过滤、洗涤,得滤液并将其稀释至200g(过程中损耗忽略不计),计算该滤液中溶质的质量分数为________.(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)[注:(3)、(4)两问需写出计算过程].
(6)喜欢探究又善于思考的周泽坤出这样题目考大家:把30g含Fe、Al、Mg、Zn的金属粉末投入适量的稀硫酸中全部溶解完,再将溶液蒸干得无水干燥固体126g,则同时产生的氢气质量为________g;探究中泽坤发现:用相同浓度的硫酸,与一瓶未变质、部分变质、全变质(杂质都是氢氧化钙)的生石灰样品反应,需要的硫酸质量都相等,其原因是________.
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:
(1)硫酸由______元素、______元素、______元素组成,它含氧元素,它______(是、不是)氧化物;磷酸相对分子质量为______;你认为硫酸与磷酸含氧元素质量相等的条件是______;
(2)该试剂瓶中硫酸溶液的质量是______g.
(3)工会主席王赐用20g该浓硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈.他在配制该溶液时所用98%的浓硫酸与水的质量比应该为______.
(4)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量.
(5)若加入的稀硫酸刚好使沉淀达最大量时,将所得混合物过滤、洗涤,得滤液并将其稀释至200g(过程中损耗忽略不计),计算该滤液中溶质的质量分数为______.(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)[注:(3)、(4)两问需写出计算过程].
(6)喜欢探究又善于思考的周泽坤出这样题目考大家:把30g含Fe、Al、Mg、Zn的金属粉末投入适量的稀硫酸中全部溶解完,再将溶液蒸干得无水干燥固体126g,则同时产生的氢气质量为______g;探究中泽坤发现:用相同浓度的硫酸,与一瓶未变质、部分变质、全变质(杂质都是氢氧化钙)的生石灰样品反应,需要的硫酸质量都相等,其原因是______.

| 硫酸(500mL) 品 名 硫酸 化学式 H2SO4 相对分子质量98 密 度 1.84g/cm3 质量分数98% |
(2)该试剂瓶中硫酸溶液的质量是______g.
(3)工会主席王赐用20g该浓硫酸配制20%的稀硫酸,以清洗钢铁表面的铁锈.他在配制该溶液时所用98%的浓硫酸与水的质量比应该为______.
(4)某固体物质由氯化钠和氯化钡组成,取32.8g该固体混合物完全溶于水,并逐滴加入上述20%的稀硫酸,产生沉淀的质量与加入稀硫酸的质量有如图所示关系,计算32.8g固体混合物中氯化钠和氯化钡的质量.
(5)若加入的稀硫酸刚好使沉淀达最大量时,将所得混合物过滤、洗涤,得滤液并将其稀释至200g(过程中损耗忽略不计),计算该滤液中溶质的质量分数为______.(若溶液中含有多种溶质,则每种溶质的质量分数为该溶质的质量与溶液总质量之比)[注:(3)、(4)两问需写出计算过程].
(6)喜欢探究又善于思考的周泽坤出这样题目考大家:把30g含Fe、Al、Mg、Zn的金属粉末投入适量的稀硫酸中全部溶解完,再将溶液蒸干得无水干燥固体126g,则同时产生的氢气质量为______g;探究中泽坤发现:用相同浓度的硫酸,与一瓶未变质、部分变质、全变质(杂质都是氢氧化钙)的生石灰样品反应,需要的硫酸质量都相等,其原因是______.

 现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算:
现有一瓶未开启的浓硫酸,试剂瓶标签上的部分内容如图所示.请根据有关信息回答并计算: