题目内容
【题目】酸、碱、盐在生产生活中具有广泛的用途。
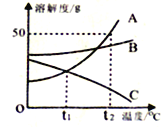
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色 溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 | A+B | A+C | A+D | B+C |
现象 | 产生气体 | 产生沉淀 | 产生沉淀 | 产生沉淀 |
①写出溶液 B、C 中溶质的化学式: B_____,C_____。
②写出溶液 A 与 D 反应的化学方程式_____。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X; 2NaHCO3Na2CO3+H2O+CO2↑等;
回答下列问题:
①X 的化学式为_____。
②将碳酸钠和碳酸氢钠的混合物 l0g 充分加热至质量不再改变,冷却,称量剩余固体 质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为_____(写最简比)。
【答案】H2SO4 BaCl2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH NH4Cl 4∶21
【解析】
稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五种溶液,能与两种物质发生反应生成沉淀的是碳酸钠、氯化钡,其中碳酸钠能与稀硫酸反应生成气体,所以A是碳酸钠,B是稀硫酸,稀硫酸能与氯化钡溶液反应生成沉淀,所以C是氯化钡,碳酸钠溶液能与氢氧化钙溶液反应生成沉淀,故D是氢氧化钙,则E是氢氧化钠。①溶液B、C中溶质分别是H2SO4、BaCl2 ②溶液A与D反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
(2)①化学反应前后各种原子个数相等,所以X的化学式为NH4Cl。
②设原混合物中碳酸氢钠的质量为x。
2NaHCO3![]() Na2CO3 + H2O + CO2↑ 固体的差量
Na2CO3 + H2O + CO2↑ 固体的差量
168 106 168-106=62
x l0g-6.9g=3.1g
![]() =
=![]() ,解得x=8.4g,原混合物中碳酸钠的质量是:l0g-8.4g=1.6g
,解得x=8.4g,原混合物中碳酸钠的质量是:l0g-8.4g=1.6g
则原混合物中碳酸钠和碳酸氢钠的质量比为:1.6g:8.4g=4:21

 名师伴你成长课时同步学练测系列答案
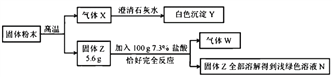
名师伴你成长课时同步学练测系列答案【题目】某化学兴趣小组同学对家用普通干电池中含有的物质产生了浓厚的兴趣。他们剥开电池时闻到氨味且发现有黑色物质。
(提出问题)为什么有氨味?黑色物质的成分是什么?
(猜想假设)能闻到氨味说明含有铵盐(如NH4Cl);黑色固体可能有铁粉、氧化铜或二氧化锰。
(实验探究)同学们分别设计实验进行探究。
实验I.小聪取适量黑色物质与______________混合置于研钵内研磨,嗅到强烈氨味,再用湿润的红色石蕊试纸检测,观察到试纸变蓝,证明黑色物质中含有铵盐。
实验II.小敏将黑色物质加入适量的水中搅拌溶解,静置后______,取不溶物进行实验。
实验步骤 | 实验现象 | 实验结论 |
1.取适量黑色滤渣装入试管中,再加入过量稀盐酸 | 无气泡生成,溶液不变色 | ________________ |
2.取适量黑色滤渣装入另一支试管中,再加入______溶液,向上述试管中伸入带火星的小木条。 | _________________ | 黑色粉末中含有二氧化锰 |
(交流讨论)步骤2中发生反应的化学方程式为______________。