题目内容
 已知:AlCl3+3NaOH═Al(OH)3↓+3NaCl Al(OH)3+NaOH═NaAlO2+2H2O
已知:AlCl3+3NaOH═Al(OH)3↓+3NaCl Al(OH)3+NaOH═NaAlO2+2H2O则:某研究性学习小组称取NaCl和AlCl3的混合物30g,将其配成溶液,再向其中逐滴加入40%的氢氧化钠溶液.(NaAlO2可溶于水)
(1)可以看到何种现象:
(2)若在实验中测得最多生成沉淀15.6g,计算原混合物中NaCl的质量分数和溶解沉淀所消耗NaOH溶液的质量.
(3)在坐标系中画出沉淀的质量(纵坐标)与所加入氢氧化钠溶液质量(横坐标)的关系图.
分析:(1)根据化学反应来分析可知当有氢氧化铝生成时,溶液有沉淀生成,再加氢氧化钠时,生成可溶于水的NaAlO2,沉淀消失;
(2)根据最多生成的沉淀的质量15.6g代入AlCl3+3NaOH═Al(OH)3↓+3NaCl 来计算氯化铝的质量,进一步计算氯化钠的质量分数;利用Al(OH)3+NaOH═NaAlO2+2H2O来计算溶解沉淀所消耗NaOH溶液的质量;
(3)根据计算可以判断生成沉淀和溶解沉淀消耗的氢氧化钠的质量比,找出关键点,画出关系图.
(2)根据最多生成的沉淀的质量15.6g代入AlCl3+3NaOH═Al(OH)3↓+3NaCl 来计算氯化铝的质量,进一步计算氯化钠的质量分数;利用Al(OH)3+NaOH═NaAlO2+2H2O来计算溶解沉淀所消耗NaOH溶液的质量;
(3)根据计算可以判断生成沉淀和溶解沉淀消耗的氢氧化钠的质量比,找出关键点,画出关系图.
解答:解:(1)根据氯化铝中加氢氧化钠生成氢氧化铝沉淀,再加氢氧化钠生成NaAlO2,沉淀逐渐溶解至消失,故答案为:先有沉淀后溶解;
(2)设氯化铝的质量为xg,则
AlCl3+3NaOH═Al(OH)3↓+3NaCl
133.5 78
x 15.6g
=
,解得x=26.7g
则氯化钠的质量为30g-26.7g=3.3g,
氯化钠的质量分数为
×100%=11%;
设溶解沉淀消耗的氢氧化钠溶液的质量为yg,则由
AlCl3+3NaOH═Al(OH)3↓+3NaCl
Al(OH)3+NaOH═NaAlO2+2H2O
得到沉淀溶解时需要的氢氧化钠的关系为:
Al(OH)3~4NaOH
78 4×40
15.6g y×40%
=
,解得y=80g,
答:原混合物中NaCl的质量分数为11%,溶解沉淀所消耗NaOH溶液的质量为80g;
(3)根据化学反应可知,AlCl3+3NaOH═Al(OH)3↓+3NaCl 完全反应时沉淀最多,再发生
Al(OH)3+NaOH═NaAlO2+2H2O反应时,消耗的氢氧化钠的质量比为3:1,最后沉淀完全溶解.
故答案为:
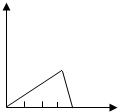 .
.
(2)设氯化铝的质量为xg,则
AlCl3+3NaOH═Al(OH)3↓+3NaCl
133.5 78
x 15.6g
| 133.5 |
| x |
| 78 |
| 15.6g |
则氯化钠的质量为30g-26.7g=3.3g,
氯化钠的质量分数为
| 3.3g |
| 30g |
设溶解沉淀消耗的氢氧化钠溶液的质量为yg,则由
AlCl3+3NaOH═Al(OH)3↓+3NaCl
Al(OH)3+NaOH═NaAlO2+2H2O
得到沉淀溶解时需要的氢氧化钠的关系为:
Al(OH)3~4NaOH
78 4×40
15.6g y×40%
| 78 |
| 15.6g |
| 4×40 |
| y×40% |
答:原混合物中NaCl的质量分数为11%,溶解沉淀所消耗NaOH溶液的质量为80g;
(3)根据化学反应可知,AlCl3+3NaOH═Al(OH)3↓+3NaCl 完全反应时沉淀最多,再发生
Al(OH)3+NaOH═NaAlO2+2H2O反应时,消耗的氢氧化钠的质量比为3:1,最后沉淀完全溶解.
故答案为:
 .
.点评:本题较复杂,学生在分析化学反应的现象时应注意和反应相对应,并能利用反应进行计算和图象的分析,有利于学生思维严密性的训练.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 已知:AlCl3+3NaOH═Al(OH)3↓+3NaCl Al(OH)3+NaOH═NaAlO2+2H2O
已知:AlCl3+3NaOH═Al(OH)3↓+3NaCl Al(OH)3+NaOH═NaAlO2+2H2O