��Ŀ����
����Ŀ���г���������������ƻƽ��Cu��Zn�Ͻ��Cu��Ag�Ͻ���Ʒ����ʵ����ֻ�ṩһƿ
ϡ����ͱ�Ҫ������
��1������Ϊ�ܲ���Ͻ���ͭ������������
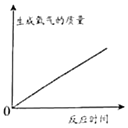
��2��ȡ������1���еĺϽ��ĩ20�˷����ձ��У�����50�˵�ϡ���ᣬǡ����ȫ��Ӧ����
���ձ���ʣ���������Ϊ69.8�ˣ���
�ٲ���������������
��ϡ���������ʵ�����������
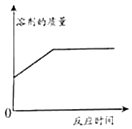
��3����ʵ���У��������������������Zn��������Ȼ�����ͭ��������������������ͬѧ
��Ϊ������ͨ���ⶨ��������������Cu��������������ͬѧ�ķ����� ��
���𰸡�
��1��Cu-Zn
��2��
�ٲ�������������Ϊ��20g+50g-69.8g=0.2g
�ڽ⣺��μӷ�Ӧ��H2SO4������Ϊx��
Zn + H2SO4 = ZnSO4 + H2��
98 2
x 0.2g
![]() =
=![]()
��ã�x=9.8g
ϡ���������ʵ���������Ϊ��![]() ��100%=19.6%
��100%=19.6%
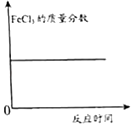
��3������Ӧ����ձ��е����ʹ��ˣ�ϴ�ӣ���������ɣ�������������ΪCu������������![]() ��������Ͻ���Cu������������
��������Ͻ���Cu������������
���������⣺��1��Cu-Ag�Ͻ��е�Cu��Ag��������ϡ���ᷢ���û���Ӧ��Cu-Zn�Ͻ��е�Zn����ϡ���ᷢ���û���Ӧ�����ܲ��Cu-Zn�Ͻ���ͭ��������������2���ٸ��������غ㶨�ɣ��ڻ�ѧ��Ӧ�У��μӷ�Ӧǰ�����ʵ������ܺ͵��ڷ�Ӧ�����ɵĸ����ʵ������ܺͣ�������������������=20g+50g-69.8g=0.2g���ڸ���п��ϡ���ᷴӦ���������������������û�ѧ����ʽ����������ʼ�Ĺ�ϵ���б���ʽ������μӷ�Ӧ�ĵ�H2SO4�������������ϡ���������ʵ�����������
�裺�μӷ�Ӧ��H2SO4������Ϊx��
Zn + H2SO4 = ZnSO4 + H2��
98 2
x 0.2g![]() =
=![]()
��ã�x=9.8g
ϡ���������ʵ���������Ϊ��![]() ��100%=19.6%
��100%=19.6%
��3��п��ϡ�����ַ�Ӧ���ձ��о�ֻʣ��Cu���壬���˺�ϴ�ӡ�����Ϳ���ֱ�ӵõ�ͭ������������![]() ��������Ͻ���ͭ������������
��������Ͻ���ͭ������������
�����㾫����������Ŀ����֪�������������ʵ����������ͽ������˳����Ӧ�õ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ�������ʵ���������=(��������/��Һ����)*100% = [��������/(��������+�ܼ�����]*100%���ڽ������˳���1��������λ��Խ��ǰ�����Ļ�Ծ�Խǿ2��λ����ǰ��Ľ������û������ᡢϡ�����е��⣨������Ũ���ᡢ���ᣩ3��λ��ǰ��Ľ����ܰ�λ�ں���Ľ��������ǵ�����Һ���û�����������K��Ca��Na����