题目内容
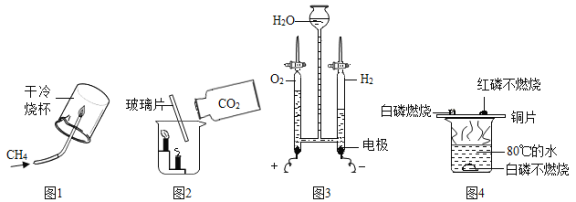
【题目】某班同学按如图所示的实验探究质量守恒定律。

(1)同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中发生反应的化学方程式为____________________________。该实验中,大家进行了两次称量,有四个小组得到下列数据:
A | B | C | D | |
盐酸加入NaCO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
盐酸加入NaCO3粉末前后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
其中有问题的两组数据是__________(填序号)。
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴入盐酸,最终天平的状态是____________。
A 左盘高B 右盘高C 保持平衡
【答案】Na2CO3+2HCl=2NaCl+H2O+CO2↑ AD C
【解析】
(1)碳酸钠(Na2CO3)粉末与盐酸(HCl)反应,产生二氧化碳气体、水和氯化钠,反应的化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2;由于实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以,反应后质量会减轻,而A组数据不变,D组数据增加,故AD两组数据有问题;
(2)由于反应在密闭容器中进行,因此容器中所盛的物质的总质量不变,最终天平的状态是保持平衡。
故答案:(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑,AD
(2)C

 阅读快车系列答案
阅读快车系列答案【题目】![]() 为绿色氧化剂,为了便贮存运输,工业上采用“醇析法”将其转化成固态过碳酸钠晶体(化学式为
为绿色氧化剂,为了便贮存运输,工业上采用“醇析法”将其转化成固态过碳酸钠晶体(化学式为![]() ),过碳酸钠溶于水时又分解生成碳酸钠和过氧化氢。
),过碳酸钠溶于水时又分解生成碳酸钠和过氧化氢。
(1)“醇析法”生产的工艺流程如下:
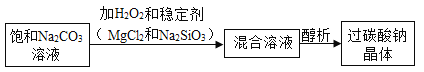
写出生成过碳酸钠晶体的化学方程式:_____。
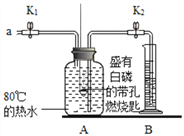
(2)图甲是一种名为“污渍爆炸盐”的洗涤品,能高效去污。小健同学欲通过实验验证其主要成分。
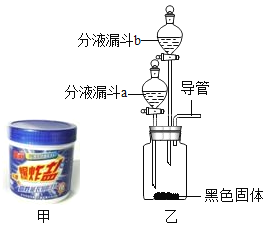
(查阅资料)“污渍爆炸盐”的主要成分是过碳酸钠。
(设计与实验)
小健同学设计的主要实验装置如图乙所示,请你运用初中所学知识,帮助小健同学完成下列实验报告。
序号 | 主要操作步骤 | 主要实验现象 |
① | 在集气瓶中加入少量_____(黑色固体); 在分液漏斗a中加入新配制的“污渍爆炸盐”的饱和水溶液; 在分液漏斗b中加入_____溶液(以上两空均填化学式) | |
② | 打开分液漏斗a的活塞,放出适量溶液后,关闭活塞 | 立即产生大量气泡 |
然后用_____接近导管口 | _____ | |
结论:“污渍爆炸盐”溶于水生成_____(填物质名称) | ||
③ | 待第②步反应停止后,打开分液漏斗b的活塞,放出足量溶液后,关闭活塞 | 产生白色沉淀 |
结论:“污渍爆炸盐”溶于水生成_____(填物质名称) | ||
(实验反思)
①保存“污渍爆炸盐”时要注意_____(写一条)。
②为了进一步确定“污渍爆炸盐”中过碳酸钠的含量,可选择的条件有_____(选填字母)。
A 产生的气体的质量
B 产生的白色沉淀的质量
C 分液漏斗a中液体的质量
D 分液漏斗b中液体的质量