题目内容
现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与烧杯内物质的质量变化如下表所示:
| 反应时间/s | 20 | 40 | 60 | 80 | 100 | 120 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |
解:根据质量守恒定律,可得出反应生成的CO2质量为:105.4g+15g-116g=4.4g
设参加反应的碳酸钙质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
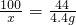
x=10 g
样品中CaCO3 的质量分数=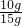 ×100%≈66.7%?
×100%≈66.7%?
答:样品中碳酸钙的质量分数66.7%.
分析:根据题意,石灰石样品中碳酸钙与盐酸反应生成了二氧化碳,质量减少,通过第100~120秒的烧杯及所盛物质质量对比分析,到第100分钟秒反应已停止,由此根据质量守恒定律,烧杯中减少的质量就是生成的二氧化碳的质量,进而求出碳酸钙的质量.
点评:本题难度不是很大,主要考查了质量守恒定律的应用和根据化学方程式进行有关的计算,培养学生分析问题的能力和解决问题的能力.
设参加反应的碳酸钙质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
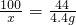
x=10 g
样品中CaCO3 的质量分数=
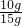 ×100%≈66.7%?
×100%≈66.7%?答:样品中碳酸钙的质量分数66.7%.
分析:根据题意,石灰石样品中碳酸钙与盐酸反应生成了二氧化碳,质量减少,通过第100~120秒的烧杯及所盛物质质量对比分析,到第100分钟秒反应已停止,由此根据质量守恒定律,烧杯中减少的质量就是生成的二氧化碳的质量,进而求出碳酸钙的质量.
点评:本题难度不是很大,主要考查了质量守恒定律的应用和根据化学方程式进行有关的计算,培养学生分析问题的能力和解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2011年贵州安顺,14题)现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:
| 反应时间/s | 20 | 20 | 20 | 20 | 20 | 20 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |
请计算回答:(1)样品中碳酸钙的质量分数。(计算结果保留1位小数)
(2)反应后所得溶液中溶质的质量分数。
(2011年贵州安顺,14题)现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反应前后烧杯内物质的质量变化如下表所示:
| 反应时间/s | 20 | 20 | 20 | 20 | 20 | 20 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |
请计算回答:(1)样品中碳酸钙的质量分数。(计算结果保留1位小数)
(2)反应后所得溶液中溶质的质量分数。
现将石灰石样品15g与105.4g稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与烧杯内物质的质量变化如下表所示:
请计算回答:样品中碳酸钙的质量分数.(计算结果保留到0.1%)
| 反应时间/s | 20 | 40 | 60 | 80 | 100 | 120 |
| 质量/g | 119.52 | 118.64 | 117.76 | 116.88 | 116 | 116 |