题目内容
【题目】以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如下: 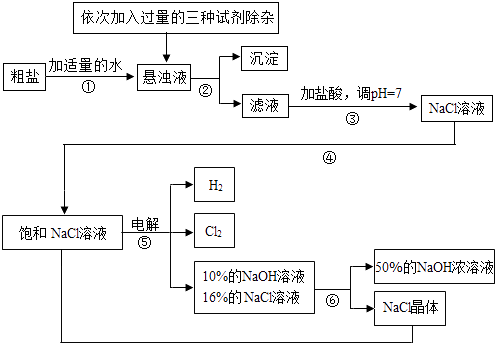
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途.下列关于氢氧化钠的描述中,错误的是 .
A.能去除油污,可做厨房清洁剂
B.易溶于水,溶解时放出大量的热
C.水溶液能使石蕊溶液变红
D.可用作某些气体的干燥剂
(2)操作②的名称是 , 操作④的名称是 .
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之(填“前”或“后”)加入.有同学提出用溶液代替BaCl2溶液可达到同样的目的.
(4)电解饱和NaCl溶液的化学方程式是 .
(5)该流程中可以循环利用的物质是 .
【答案】
(1)C
(2)过滤;蒸发
(3)后;Ba(OH)2
(4)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(5)NaCl
【解析】解:(1)A、氢氧化钠可以和油污反应生成硬脂酸钠而将油污溶解,故A正确, B、氢氧化钠极易溶于水,并且放出大量的热,故B正确,
C、石蕊遇碱变蓝色,故C错误,
D、氢氧化钠具有吸水潮解的性质,所以可以干燥某些气体,故D正确,
故选:C.(2)过滤是将固体和液体进行分离的一种操作,经过操作②后分出了溶液和固体,所以答案是:过滤,
经过作④后溶液由不饱和变成了饱和状态,说明水分减少了.
所以答案是:蒸发.(3)加入过量的氯化钡是为了除去硫酸钠,加入过量的碳酸钠是为了除去剩余的氯化钡和氯化钙,顺序加反后,剩余的氯化钡也就成了杂质.
所以答案是:后.
氯化钡是为了除去硫酸根离子,加入氢氧化钡后钡离子可以将硫酸根离子沉淀,氢氧根离子能够被盐酸反应,不会引入新的杂质离子.
所以答案是:Ba(OH)2 , (4)饱和的氯化钠在通电的条件下生成氯化钠、氢气和氯气,所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑(5)根据装置图可以看出,电解反应后的溶液中依然存在氯化钠,氯化钠蒸发变成饱和状态时又可以电解.
2NaOH+H2↑+Cl2↑(5)根据装置图可以看出,电解反应后的溶液中依然存在氯化钠,氯化钠蒸发变成饱和状态时又可以电解.
所以答案是:NaCl.
【考点精析】认真审题,首先需要了解溶解时的吸热或放热现象(溶解时放热、吸热现象<溶解吸热:如NH4NO3溶解;溶解放热:如NaOH溶解、浓H2SO4溶解;解没有明显热现象:如NaCl>),还要掌握书写化学方程式、文字表达式、电离方程式(注意:a、配平 b、条件 c、箭号)的相关知识才是答题的关键.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案