题目内容
【题目】某校甲、乙两兴趣小组进行硫酸铜溶液与与氢氧化钠溶液的实验。
甲组实验:先往试管中各加入2mL 10%的CuSO4溶液,再往试管中加入5mL 10%的NaOH溶液,观察到试管中有蓝色沉淀生成。
乙组实验:先往试管中各加入2mL 10%的CuSO4溶液,再往试管中加入2滴10%的NaOH溶液,观察到试管中有浅绿色沉淀生成(与甲组的沉淀颜色差别较大)。
【实验讨论】甲组实验中的蓝色沉淀是氢氧化铜,写出反应的化学方程式: 。
那么乙组实验中浅绿色沉淀是什么呢?
【查阅资料】
(1)NaOH溶液和CuSO4溶液反应可生成多种组成的碱式硫酸铜,它们都是浅绿色固体。如Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4,它们的相对分子质量分别为258、356、454。
(2)各种组成的碱式硫酸铜,受热均会分解。
(3)SO2气体能使酸性高锰酸钾稀溶液褪色。
(4)白色的无水CuSO4固体吸收水蒸气后变成变蓝色固体。
【实验探究】该小组对碱式硫酸铜产生了兴趣,想探究碱式硫酸铜受热分解的产物。
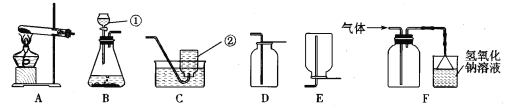
【实验设计】取少量碱式硫酸铜加入试管中并按以下流程进行实验:

实验结束后,试管中残留有黑色固体,滴入稀硫酸黑色固体溶解,溶液呈蓝色,证明黑色固体是CuO;B中无水CuSO4变蓝色,证明有 生成;C中现象为 ,证明生成SO2;D中气体能使带火星木条复燃,证明生成O2.
【实验反思】
(1)当NaOH溶液和CuSO4溶液反应时,只要控制CuSO4溶液的量一定,NaOH溶液 (填“过量”或“不足”)时就能生成浅绿色沉淀。
(2)若碱式硫酸铜Cu3(OH) 4SO4可表示为:2Cu(OH)2 CuSO4,则Cu4(OH)6SO4还可表示为: 。
【拓展延伸】
(1)当反应物相同,而反应物的量不同,产物可能不同。试另举一个例子: 。
(2)当反应物相同,而 不同时,产物也可能不同。如常温下二氧化碳和水反应生成碳酸;在光照作用下,二氧化碳和水在植物的叶子中发生光合作用生成氧气。
(3)为了确定所得浅绿色沉淀的组成,再进行后续实验,取8.9g碱式硫酸铜(假设化学式为:aCu(OH)2 bCuSO4)放入试管中加热,充分反应后生成了0.9g水,通过计算确定所得浅绿色沉淀的化学式为 。
【答案】CuSO4 + 2NaOH Cu(OH)2↓+ Na2SO4
【实验设计】 水(或H2O) 高锰酸钾稀溶液的紫色褪色(或紫色变浅)
【实验反思】(1)不足 (2)3Cu(OH)2 CuSO4
【拓展延伸】(1)碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳(其他合理答案也可)
(2)反应条件(3)2Cu(OH)2 CuSO4 (或Cu3(OH)4SO4)
【解析】
试题分析:甲组实验中的蓝色沉淀是氢氧化铜,反应的化学方程式:CuSO4 + 2NaOH Cu(OH)2↓+ Na2SO4;实验结束后,试管中残留有黑色固体,滴入稀硫酸黑色固体溶解,溶液呈蓝色,证明黑色固体是CuO;B中无水CuSO4变蓝色,证明有水生成;C中现象为高锰酸钾稀溶液的紫色褪色(或紫色变浅),证明生成SO2;D中气体能使带火星木条复燃,证明生成O2.当NaOH溶液和CuSO4溶液反应时,只要控制CuSO4溶液的量一定,NaOH溶液不足时就能生成浅绿色沉淀。若碱式硫酸铜Cu3(OH) 4SO4可表示为:2Cu(OH)2 CuSO4,则Cu4(OH)6SO4还可表示为:3Cu(OH)2 CuSO4。当反应物相同,而反应物的量不同,产物可能不同。碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳。当反应物相同,而反应条件不同时,产物也可能不同。如常温下二氧化碳和水反应生成碳酸;在光照作用下,二氧化碳和水在植物的叶子中发生光合作用生成氧气。为了确定所得浅绿色沉淀的组成,再进行后续实验,取8.9g碱式硫酸铜(假设化学式为:aCu(OH)2 bCuSO4)放入试管中加热,充分反应后生成了0.9g水,确定所得浅绿色沉淀的化学式为:氢元素的质量=0.9克*2/18×100%=0.1克,根据元素的质量的关系得出Cu(OH)2中M铜元素:M氧元素:M氢元素=32:16:1,得出其中的铜元素的质量=3.2克,氧元素的质量=1.6克,所以其中CuSO4的质量=8.9克-3.2克-1.6克-0.1克=4.0克,所以98a:160b=4.9克:4克 解得a:b=2:1.

【题目】下表各组中,实验操作和目的对应关系正确的是 ( )
选项 | 实验操作 | 实验目的 |
A | 硫在氧气中燃烧时,集气瓶底部放少量水 | 防止炸裂瓶底 |
B | 实验室制取蒸馏水时,向水中加入碎瓷石 | 防止加热时出现暴沸 |
C | 用双氧水制氧气时,加入少量二氧化锰 | 得到更多的氧气 |
D | 将较浑浊的泥沙水进行过滤前,须先静置一会儿 | 节省过滤时间 |