题目内容
【题目】实验室用过量的稀盐酸和大理石制取CO2 , 取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系如下图所示。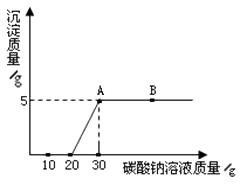
回答下列问题:
(1)从图中看出生成沉淀的最大质量是g。
(2)如图,当滴加碳酸钠溶液质量为10g时,溶液中的溶质是 (写化学式)。
(3)图中AB段表示的意义是。
(4)计算实验所用碳酸钠溶液的溶质质量分数。
【答案】
(1)5
(2)HCl、CaCl2、NaCl
(3)反应结束,碳酸钠溶液过量(或碳酸钠溶液过量)
(4)解:由图示可知,滴加碳酸钠溶液10g生成5g碳酸钙沉淀,设10g碳酸钠溶液中碳酸钠的质量为x,
Na2CO3 + CaCl2 = | CaCO3↓ +2NaCl |
106 | 100 |
x | 5g |
![]() =
= ![]() ,解得:x=5.3g,
,解得:x=5.3g,
则所用碳酸钠溶液的溶质质量分数为 ![]() ×100%=53%。
×100%=53%。
【解析】有图示可知,滴加碳酸钠溶液20g时开始出现沉淀,说明前20g碳酸钠溶液是与混合液中过量的盐酸反应,与盐酸完全反应后继续滴加碳酸钠溶液生成沉淀碳酸钙;(1)从图中看出生成沉淀的最大质量是5g;(2)如图,最初滴加的碳酸钠与过量的盐酸反应生成氯化钠和水、CO2,滴加碳酸钠溶液20g时才能将过量的盐酸完全反应掉,则当滴加碳酸钠溶液质量为10g时,溶液中的溶质为NaCl、HCl及CaCl2;(3)图中AB段滴加碳酸钠溶液沉淀量不再增加,表示反应结束,碳酸钠溶液过量;
【考点精析】关于本题考查的质量守恒定律及其应用和根据化学反应方程式的计算,需要了解①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案