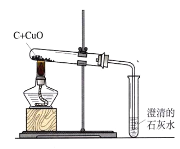
题目内容
将金属X置于氯化铝溶液中,X表面无固体析出;而将其置于硝酸银溶液中,会发生反应:X + 2AgNO3 = X(NO3)2 + 2Ag。由此可判断X、Al、Ag的金属活动性顺序为( )
A.Al>Ag>X B.Ag>X>Al C.Al>X>Ag D.X>Al>Ag
练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
根据金属活动性顺序的相关知识,回答下列问题:
(1)将某金属M加入到稀硫酸中,观察到金属M表面有气泡产生,据此,你能得到的确切信息是__________。
(2)在相同的条件下,把金属M及另外三种金属分别加入质量分数相同的等质量的稀硫酸中,观察反应产生气泡的剧烈程度,并记录如下(反应剧烈程度用“+”表示)
金属 | 金属1 | 金属2 | 金属M | 金属3 |
反应剧烈程度 | + + + + | + + + | + + | + |
如果上述金属分别是Al、Mg、Fe、Zn,你认为金属M最有可能是_______。
(3)向硝酸银溶液和硝酸铜的混合溶液中加 入一些镁粉,充分反应后过滤。若向滤渣中滴加稀盐酸没有气泡冒出,则了残渣中一定含有的金属是________,滤液中一定含有的溶质是________,反应后溶液(滤液)的质量与原混合溶液的质量相比将_________ (填“变大”、“变小”、“无法确定”)
一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 50 | 0.5 | 0 | 0 |
反应后的质量/g | 23 | X | 24 | 3 |
A.X 的值等于 0
B.甲一定是化合物
C.丙和丁的质量变化比为 8:1
D.该反应是分解反应


 稀释浓硫酸 B.
稀释浓硫酸 B. 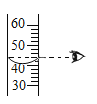 读取液体体积
读取液体体积 加入固体粉末 D.
加入固体粉末 D.  验满
验满