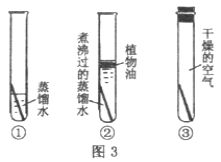
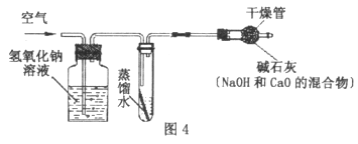
题目内容
【题目】某建筑工地发生民工食物中毒事件,经化验为误食工业用盐亚硝酸钠(NaNO2)所致.亚硝酸钠中氮元素的化合价是( )
A.+2 B.+3 C.+4 D.+5
【答案】B
【解析】设化合物NaNO2中N元素化合价为x,其中Na为+1价、O为﹣2价,依化合物中各元素化合价代数和为零的原则有
(+1)+x+(﹣2)×2=0,
解得x=+3.故选B.

 名校课堂系列答案
名校课堂系列答案【题目】【2014年贵州省黔东南州市】学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2═2MgO+C,所以镁着火不能来CO2来灭火,但没有找到有关Na能否与CO2反应的介绍.于是同学们展开了钠着火能否用CO2来灭火的探究.
【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程式为 _________ .
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧.
进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,也能与H2O反应生成NaOH.
②Ba(OH)2溶于而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
Ⅰ.Na2O、C;Ⅱ _________ 、C;Ⅲ.NaOH、C;Ⅳ.Na2O、Na2CO3、C
通过理论分析,猜想 _________ (填序号)肯定错误的,理由是 _________
【验证猜想】
步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有C |
(2) | 取少量(1)所得上层溶液,加入过量的BaCl2溶液 | _________ | 燃烧产物中肯定有Na2CO3 |
(3) | 取少量(2)所得上层清液,加入 _________ 溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有 _________ |
在步骤(2)中BaCl2溶液为什么要加入至过量?其原因是: _________ .
【结论】猜想 _________ (填序号)是正确的.