题目内容
请回忆你和老师共同完成的酸和碱反应的实验探究,并下列要求进行实验的设计与分析:
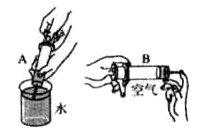
(1)请你依据下图设计一个酸和碱反应的探究实验:

(2)我选取BaCl2、酚酞、紫色石蕊三种溶液设计实验,分别探究上述酸、碱反应后烧杯中的硫酸是否过量,请你根据下表帮我判断正确的实验方案及分析方案错误的原因:
①设计的三个方案中,有一个正确的方案是:方案 。
②请分析另外两个方案,错误的原因:
一个方案错误的原因是: ;
另一个方案错误的原因是: 。
(1)请你依据下图设计一个酸和碱反应的探究实验:

| 实验步骤 | 实验现象 | 结论 |
| ①向烧杯中加入10ml氢氧化钠溶液,并滴入几滴酚酞溶液; ②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液。 | ①溶液颜色 ; ②不断搅拌溶液至溶液颜色恰好变成 色为止。 | 酸和碱发生了中和反应,该反应属四种基本反应类型中的 反应。 |
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好反应 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
②请分析另外两个方案,错误的原因:
一个方案错误的原因是: ;
另一个方案错误的原因是: 。
(1)红色 无色 复分解反应
(2)方案一 方案二中,酚酞不变色,只能说明溶液不呈碱性,如果硫酸过量酚酞也不变色,故得出恰好反应的结论不正确。
(2)方案一 方案二中,酚酞不变色,只能说明溶液不呈碱性,如果硫酸过量酚酞也不变色,故得出恰好反应的结论不正确。
答:(1)氢氧化钠溶液中滴入酚酞试液溶液变成红色,再向里面滴加稀硫酸,红色慢慢消失,当红色刚好褪去时,说明氢氧化钠与稀硫酸恰好完全反应,该反应是两种化合物相互交换成分生成另外两种化合物是复分解反应,故答案为:红色;无色;复分解反应.
(2)方案一中,向溶液中滴加氯化钡,即使稀硫酸不过量,也会出现白色沉淀,因为溶液中有生成的硫酸钠,存在硫酸根离子;方案二中,酚酞不变色,只能说明溶液不呈碱性,如果硫酸过量酚酞也不变色,故得出恰好反应的结论不正确.故答案为;三;

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目