题目内容
实验室里用加热氯酸钾(在催化剂MnO2存在下)的方法制取氧气.在大试管里加入4.9克的氯酸钾和0.5克二氧化锰,用排水法收集氧气.加热一段时间后,停止加热,待试管里的残留固体完全冷却后,称的固体质量为4.44克.试求:(1)制的氧气是多少克?
(2)已经分解的氯酸钾的质量分数是多少?
【答案】分析:依据质量守恒定律结合反应前后固体质量的变化可求生成氧气的质量,根据氧气的质量可求出分解的氯酸钾的质量,进而依据氯酸钾的总质量可求已经分解的氯酸钾的质量分数;
解答:解:(1)根据固体质量的减少量就是生成氧气的质量,因为二氧化锰是这一反应的催化剂反应前后固体质量不变,所以加热后生成氧气质量为:4.9g+0.5g-4.44=0.96g;
(2)设要生成0.96g氧气需要参加反应的氯酸钾的质量为x则:
2KClO3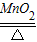 2KCl+3O2↑
2KCl+3O2↑
245 96
x 0.96g

解得x=2.45g
已经分解的氯酸钾的质量分数是 ×100%=50%
×100%=50%
答:(1)制的氧气是0.96克;
(2)已经分解的氯酸钾的质量分数是50%;
点评:此题是对化学反应方程式的考查,解答本题关键是要知道固体质量的减少量就是生成氧气的质量.
解答:解:(1)根据固体质量的减少量就是生成氧气的质量,因为二氧化锰是这一反应的催化剂反应前后固体质量不变,所以加热后生成氧气质量为:4.9g+0.5g-4.44=0.96g;
(2)设要生成0.96g氧气需要参加反应的氯酸钾的质量为x则:
2KClO3
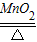 2KCl+3O2↑
2KCl+3O2↑245 96
x 0.96g

解得x=2.45g
已经分解的氯酸钾的质量分数是
 ×100%=50%
×100%=50%答:(1)制的氧气是0.96克;
(2)已经分解的氯酸钾的质量分数是50%;
点评:此题是对化学反应方程式的考查,解答本题关键是要知道固体质量的减少量就是生成氧气的质量.

练习册系列答案
相关题目