题目内容
(2012?孝感)硝酸钠、氯化钠和X(不含结晶水)三种物质的溶解度曲线如图一所示,请回答:
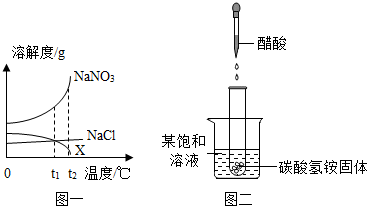
(1)t1℃时,NaNO3、NaCl、X的溶解度大小关系为
(2)如图二,往试管中滴加适量36%的醋酸,试管中发生的化学反应属于
(3)分别将NaNO3、NaCl、X的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是

(1)t1℃时,NaNO3、NaCl、X的溶解度大小关系为
SNaNO3>SNaCl=Sx(或NaNO3>NaCl=X)
SNaNO3>SNaCl=Sx(或NaNO3>NaCl=X)
.(2)如图二,往试管中滴加适量36%的醋酸,试管中发生的化学反应属于
吸热
吸热
反应(填“吸热”或“放热”),反应完成后,发现烧杯中的饱和溶液变浑浊.请判断该饱和溶液中的溶质一定不是NaNO3、NaCl、X三种物质中的X
X
.(3)分别将NaNO3、NaCl、X的饱和溶液从t2℃降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是
NaNO3%>NaCl%>X%(或NaNO3>NaCl>X
NaNO3%>NaCl%>X%(或NaNO3>NaCl>X
.分析:(1)根据某一温度时物质溶解度的比较方法考虑;
(2)根据化学反应中的放热和饱和溶液析出晶体的变化考虑;
(3)根据降温后溶质的变化情况考虑.
(2)根据化学反应中的放热和饱和溶液析出晶体的变化考虑;
(3)根据降温后溶质的变化情况考虑.
解答:解:(1)从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是:SNaNO3>SNaCl=Sx(或NaNO3>NaCl=X);
(2)碳酸氢铵与醋酸反应发生的是吸热反应,使温度降低,发现烧杯中的饱和溶液变浑浊说明有晶体析出,即降温后溶解度减小,所以不可能是X;
(3)降温后NaNO3、NaCl的溶解度都减小,会析出晶体,仍然饱和,饱和溶液的质量分数与溶解度有关:溶质质量分数=
×100%;降温到t1℃时因为NaNO3的溶解度大于NaCl的溶解度,所以降温后NaNO3的溶质质量分数大于NaCl的溶质质量分数;由于X的溶解度增大,溶质质量分数不变,因为t1℃NaCl的溶解度大于t2℃X的溶解度,所以NaCl的溶质质量分数大于X的溶质质量分数.
故答案为:
(1)SNaNO3>SNaCl=Sx(或NaNO3>NaCl=X);
(2)吸热;X;
(3)NaNO3%>NaCl%>X%(或NaNO3>NaCl>X.
(2)碳酸氢铵与醋酸反应发生的是吸热反应,使温度降低,发现烧杯中的饱和溶液变浑浊说明有晶体析出,即降温后溶解度减小,所以不可能是X;
(3)降温后NaNO3、NaCl的溶解度都减小,会析出晶体,仍然饱和,饱和溶液的质量分数与溶解度有关:溶质质量分数=
| 溶解度 |
| 100g+溶解度 |
故答案为:
(1)SNaNO3>SNaCl=Sx(或NaNO3>NaCl=X);
(2)吸热;X;
(3)NaNO3%>NaCl%>X%(或NaNO3>NaCl>X.
点评:解答本题关键是知道溶解度大小的比较,饱和溶液溶质质量分数的计算方法.尤其是降温后溶质质量分数的计算和比较方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2012?孝感)A、B、C、D、E均为初中化学常见的物质,它们之间的转化关系如图所示(其中“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物和反应条件已略去).
(2012?孝感)A、B、C、D、E均为初中化学常见的物质,它们之间的转化关系如图所示(其中“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物和反应条件已略去).