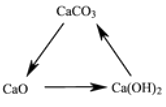
题目内容
【题目】某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行如下探究。
(1)操作①中必须用到的一种仪器是(填序号)
A.研钵
B.量筒
C.烧杯
D.试管
(2)操作③的名称是 , 操作④中用到的仪器玻璃棒,其作用为。
(3)用提纯到的“精盐”配制100g 7.5%的氯化钠溶液,经检测溶质质量分数偏小,其原因可能有(填序号)
①精盐固体不纯②称量时精盐与砝码放反了③量取水时,俯视读数 ④装瓶时,有少量溶液洒出
(4)经测定“精盐”中还含有氯化钙、氯化镁等可溶性杂质,某同学设计下列除杂流程。
a.已知试剂X 是碱溶液,则沉淀I 为(写化学式),下列碱溶液一定不能使用的是(填序号)
A.氢氧化钠溶液 B.氢氧化钡溶液 C.氢氧化钾溶液 D.氢氧化钙溶液
b.步骤②除去氯化钙的反应方程式;
c.溶液Ⅱ中含有的阴离子有(填离子符号),步骤③中发生反应的化学方程式。(任写其中一条)
【答案】
(1)A
(2)过滤,搅拌液体,防止局部温度过高造成液滴飞溅
(3)①②
(4)Mg(OH)2,C,Na2CO3+CaCl2=CaCO3↓+2NaCl,Cl- 、OH-、CO32-, Na2CO3+2HCl=2NaCl+H2O+CO2↑(或NaOH+HCl=NaCl+H2O)
【解析】操作①中必须用到的一种仪器是研钵。目的是将固体变为粉末,操作③的名称是过滤,操作④中用到的仪器玻璃棒,其作用为搅拌液体,防止局部温度过高造成液滴飞溅。用提纯到的“精盐”配制100g 7.5%的氯化钠溶液,经检测溶质质量分数偏小,其原因可能有精盐固体不纯;②称量时精盐与砝码放反了,使得固体的质量减少;量取水时,仰视读数,已知试剂X 是碱溶液,则沉淀I 为Mg(OH)2,因为氢氧化钠会和氯化镁发生反应得到氢氧化镁沉淀,下列碱溶液一定不能使用的是氢氧化钾溶液,因为最后会得到杂质氯化钾,不能被分离;步骤②除去氯化钙的反应方程式Na2CO3+CaCl2=CaCO3↓+2NaCl; 溶液Ⅱ中含有的阴离子有Cl- 、OH-、CO32-,步骤③中发生反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑,过程中盐酸密度是除掉过量的碳酸钠和氢氧化钠。
【考点精析】根据题目的已知条件,利用过滤操作的注意事项和书写化学方程式、文字表达式、电离方程式的相关知识可以得到问题的答案,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;注意:a、配平 b、条件 c、箭号.

【题目】葡萄糖是生命体所需能量的主要来源. 【提出问题】葡萄糖的燃烧产物是CO2和H2O,由此能否证明葡萄糖是只由碳元素和氢元素组成的有机物?
【实验设计】为了确定葡萄糖的元素组成,某小组设计了如图实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略).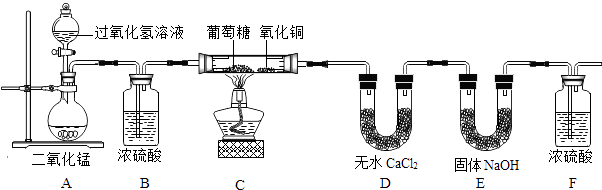
(1)装置A中发生反应的化学方程式是;
(2)装置B中浓硫酸的作用是;
(3)装置C处氧化铜的作用是;
(4)【方案评价】用充有空气的储气球代替装置A,是否更有利于实验的进行?(填“是”或“否”),原因是 .
(5)【数据处理】下表是同学们填写的实验报告,请你帮助完成.
实验事实 | 数据分析及结论 |
1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O | 根据实验数据分析:(注意:不能用葡萄糖的化学式进行计算) |
(6)【讨论交流】①葡萄糖在空气中不容易被点燃,但若在葡萄糖中掺少量烟灰,则很容易被点燃.可见,烟灰在此可能起作用. ②从定量实验的角度看,为了尽量减少误差:该实验是否可进一步改进?请简要写出一个改进意见: .