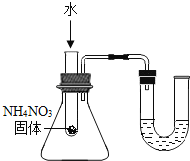
题目内容
【题目】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5.0g样品,加水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,恰好用去10%的稀盐酸36.5g。(反应的化学方程式为:NaOH + HCl = NaCl + H2O)试计算:
(1)将100g质量分数为36 %的浓盐酸稀释成10 %的稀盐酸,需加水的质量为________g。
(2)样品中氢氧化钠的质量分数_____。
【答案】 260 80%
【解析】(1)根据配制前后溶质质量不变解答;(2)根据反应的化学方程式计算解答。(1)设需加水的质量为x。100g×36%=(100g+x)×10%,x=260g;(2)设样品中氢氧化钠的质量为y。当pH=7时,恰好用去盐酸溶质的质量为36.5g×10=3.65g。
HCl+NaOH=NaCl+H2O
36.5 40
3.65g y
![]()
y=4.0g
样品中氢氧化钠的质量分数为![]() ×100%=80%
×100%=80%
答:(1)将100g质量分数为36 %的浓盐酸稀释成10 %的稀盐酸,需加水的质量为260g;(2)样品中氢氧化钠的质量分数80%。

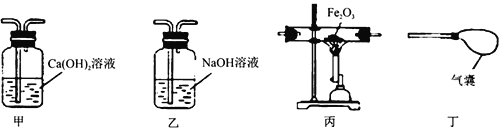
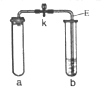
【题目】利用下表中的装置进行实验。对该实验分析推理不正确的是( )
实验装置 | 实验步骤 |
| ①将a试管充满二氧化碳,b试管加入紫色石蕊溶液(K处于关闭状态) ②密闭下,用针筒将a试管中部分二氧化碳抽出 |
A. 用针筒将部分二氧化碳抽出,a试管中气体分子间间隙变大
B. 打开K,b试管中液体颜色变红
C. 打开K,导管E液面上升
D. 打开K,发生反应:H2O+CO2=H2CO3
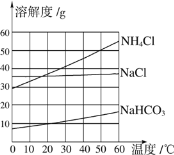
【题目】我国化学家侯德榜创立的侯氏制碱法为纯碱工业技术的发展做出了杰出的贡献。在制备纯碱的过程中涉及Na2CO3、NaCl、NH4Cl、NaHCO3等物质。请结合表格数据回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | Na2CO3 | 7 | 12.2 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
(1)表中三种物质中,溶解性属于可溶的物质是__________。
(2)在50℃时,向100g水中加入48gNa2CO3充分搅拌所得溶液质量为___________ ;保持烧杯中各物质质量不变,降温至40℃时,所得溶液溶质的质量分数会_________(填“变小”、“不变”或“变大”)。
(3)请根据表格中数据,在下图中绘制出碳酸钠的溶解度曲线。
 __________
__________
(4)根据溶解度曲线回答下列问题:
①60℃时,向等质量的上述四种固体物质中分别加水配成饱和溶液,所得溶液质量由大到小的顺序是_____________________________。
②侯氏制碱法的关键步骤是:先向饱和食盐水中通入氨气,制成饱和氨盐水,氨盐水吸收二氧化碳后生成碳酸氢钠和氯化铵,其化学方程式为NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3。请问生成的碳酸氢钠和氯化铵,哪种物质首先析出______________,理由是_________________。