题目内容
氧化亚铜与稀硫酸反应的化学方程式为:Cu2O+H2SO4=CuSO4+Cu+H2O。
(1)氧化亚铜中铜、氧元素质量比为_____
(2)实验室用98%的浓硫酸配制500g、9.8%的稀硫酸,需要水的质量为_____
(3)取一定量的氧化亚铜,加入9.8%的稀硫酸恰好完全反应,过滤、洗涤、干燥得红色固体6.4g。
计算:参加反应的稀硫酸的质量_____。
下表中对部分化学知识归纳总结正确的是( )
A | B | C | D |
①热水瓶中的水垢用食醋除去发生了化学变化 ②天然存在的最硬的物质是金刚石,用于镶嵌在玻璃刀头上 | ①墙内开花墙香,说明分子在不断运动着 ②物质只能由分子构成 | ①用观察颜色的方法区别白酒和白醋 ②点燃可燃性气体前必须验纯 | ①活性炭可以使硬水软化 ②合理施用农药、化肥可减少水体污染 |
A. A B. B C. C D. D
在催化剂和加热条件下,3.4g X和8.0g Y恰好完全反应,生成5.4g Z和另一种产物W,下列判断正确的是
X | Y | Z |
|
|
|
|
A. 物质X属于氧化物
B. 该反应属于置换反应
C. 物质W一定含有氧元素
D. 该反应的化学方程式中X、Y的化学计量数比为2:3
金属镁可与热水反应生成氢氧化镁和氢气,所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
(1)镁与热水反应的化学方程式是_____________。
(2)查阅资料:溶液红色褪去的原因是溶液碱性减弱。
(提出问题)导致溶液碱性减弱的原因是什么?
(假设与分析)
假设1:可能是氢氧化镁与N2或O2发生了反应。假设2:可能是溶液吸收了空气中的__________。
假设3:可能是氢氧化镁的溶解度随温度的降低而___________。
由碱的性质可知,假设1不成立。
(实验探究)
实验操作 | 实验现象 | 结论 |
1.取上述红色溶液,保持温度不变,在空气中放置一段时间,观察现象。 | _______________ | 假设2成立 |
2.取上述红色溶液,隔绝空气,冷却到室温,观察现象。 | 红色褪去 | 假设3成立 |
(拓展延伸)
(3)将小块金属钠投入硫酸铜溶液时,产生蓝色沉淀。请解释其原因:________。
(4)除上述金属外,根据金属活动性顺序,预测______也能跟硫酸铜溶液反应产生上述现象(举一例即可)



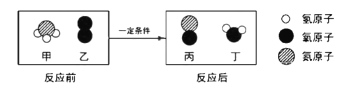
 ﹣﹣氢原子
﹣﹣氢原子 ﹣﹣氮原子
﹣﹣氮原子 ﹣﹣氧原子
﹣﹣氧原子

