��Ŀ����
п��������ϡ���ᷴӦ��������Ũ���ᷴӦ������һ��������п��Ũ�������ܱ����ڷ�����Ӧ����÷�Ӧǰ������ʵ��������±���ʾ���������й�X��˵���У���ȷ���ǣ�������
A��Xһ���Ǵ���
B��X�����Ǵ���
C��X�к���п����Ԫ��
D��X����Ԫ����������Ϊ50.0%
| ���� | Zn | H2SO4 | H2O | ZnSO4 | X |
| ��Ӧǰ������g�� | 10.0 | 48.0 | 2.0 | 0 | 0 |
| ��Ӧ��������g�� | 3.5 | 28.4 | 5.6 | 16.1 | x |
A��Xһ���Ǵ���
B��X�����Ǵ���
C��X�к���п����Ԫ��
D��X����Ԫ����������Ϊ50.0%
D
������������������غ㶨�ɣ���Ӧ��X������x=10g+48g+2g��3.5g��28.4g��5.6g��16.1g=6.4g��A��X���������ӣ����������A����B��X���������ӣ����������B����C��п�������������٣��Ƿ�Ӧ�ˮ������п��X�������ӣ����������Ӧǰ����п���⡢��������Ԫ�أ����вμӷ�Ӧ��пԪ�ص�����Ϊ10g��3.5g=6.5g���μӷ�Ӧ����������Ԫ�ص�����Ϊ��48��28.4��g��
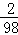 =0.4g����Ԫ�ص�����Ϊ��48��28.4��g��
=0.4g����Ԫ�ص�����Ϊ��48��28.4��g��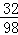 =6.4g����Ԫ�ص�����Ϊ48g��28.4g��0.4g��6.4g=12.8g�����ɵ�ˮ����Ԫ�ص�����Ϊ��5.6��2��g��
=6.4g����Ԫ�ص�����Ϊ48g��28.4g��0.4g��6.4g=12.8g�����ɵ�ˮ����Ԫ�ص�����Ϊ��5.6��2��g��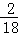 =0.4g����Ԫ�ص�����Ϊ5.6g��2g��0.4g=3.2g�����ɵ�����п��пԪ�ص�����Ϊ16.1g��
=0.4g����Ԫ�ص�����Ϊ5.6g��2g��0.4g=3.2g�����ɵ�����п��пԪ�ص�����Ϊ16.1g��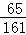 =6.5g����Ԫ�ص�����Ϊ16.1g��
=6.5g����Ԫ�ص�����Ϊ16.1g��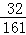 =3.2g����Ԫ�ص�����Ϊ16.1g��6.5g��3.2g=6.4g�����������غ㶨�ɿ�֪��X�к�����Ԫ�ص�����Ϊ6.4g��3.2g=3.2g��������Ԫ�ص�����Ϊ12.8g��3.2g��6.4g=3.2g�����X�к�����Ԫ�غ���Ԫ�أ���C����D����C������֪��X�к�����Ԫ�ص�����Ϊ6.4g��3.2g=3.2g��������Ԫ�ص�����Ϊ12.8g��3.2g��6.4g=3.2g�����X����Ԫ����������Ϊ
=3.2g����Ԫ�ص�����Ϊ16.1g��6.5g��3.2g=6.4g�����������غ㶨�ɿ�֪��X�к�����Ԫ�ص�����Ϊ6.4g��3.2g=3.2g��������Ԫ�ص�����Ϊ12.8g��3.2g��6.4g=3.2g�����X�к�����Ԫ�غ���Ԫ�أ���C����D����C������֪��X�к�����Ԫ�ص�����Ϊ6.4g��3.2g=3.2g��������Ԫ�ص�����Ϊ12.8g��3.2g��6.4g=3.2g�����X����Ԫ����������Ϊ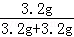 ��100%=50.0%����D��ȷ��
��100%=50.0%����D��ȷ��
��ϰ��ϵ�д�
 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
�����Ŀ
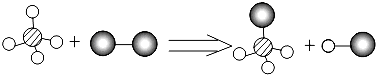
 2MgO
2MgO Na2SO4 +2H2O
Na2SO4 +2H2O