题目内容
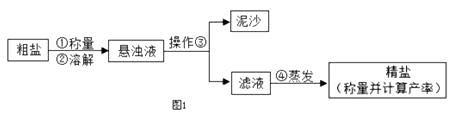
【题目】为探究Fe、Cu、Ag的金属活动性强弱,某兴趣小组做了如下实验:
(1)实验前需将金属丝打磨,目的是。
(2)甲实验中发生反应的化学方程式为。
(3)乙实验中观察到的现象为。
(4)通过甲、乙实验探究,可得出三种金属活动性由强到弱的顺序为。
(5)若采用丙实验方案也可得出相同结论,则金属C是。
【答案】
(1)除去表面的氧化物,以免影响反应
(2)Cu+2AgNO3 =Cu(NO3)2+2Ag
(3)铁丝表面有红色固体析出,溶液由蓝色变成浅绿色
(4)铁、铜、银
(5)铜
【解析】(1)金属丝表面有氧化物,打磨可除去表面的氧化物,以免影响反应;(2)甲实验中发生反应的化学方程式为 Cu + 2AgNO3 =Cu (NO3 )2 + 2Ag;(3)生成的金属附着在原来金属的表面,硫酸铜溶液是蓝色的,硫酸亚铁溶液是浅绿色的,故观察到的现象为铁丝表面有红色固体析出,溶液由蓝色变成浅绿色;(4)通过甲的实验探究,得出铜>银,通过乙的实验探究,得出铁>铜,故三种金属活动性由强到弱的顺序为铁>铜>银;(5)探究三种金属的活动性顺序,可用中间金属单质与另外两种金属的盐溶液反应,故C是铜。
故答案为:(1)除去表面的氧化物,以免影响反应;(2)Cu+2AgNO3 =Cu(NO3)2+2Ag;(3)铁丝表面有红色固体析出,溶液由蓝色变成浅绿色;(4)铁、铜、银;(5)铜。
考查学生应用金属活动性顺序的能力。

练习册系列答案
相关题目