题目内容
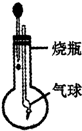 探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当胶头滴管滴入液体后,能观察到气球变大的实验组合是( )
探究小组利用如图装置进行四组实验,胶头滴管盛装的是液体,烧瓶中盛装的是气体、固体或液体,当胶头滴管滴入液体后,能观察到气球变大的实验组合是( )| 组合 | 滴管中 | 烧瓶中 |
| A | HCl | Zn |
| B | HCl | CaCO3 |
| C | Ca(OH)2 | CO2 |
| D | H2SO4(浓) | H20 |
| A、A | B、B | C、C | D、D |
考点:反应现象和本质的联系,浓硫酸的性质及浓硫酸的稀释,酸的化学性质,碱的化学性质
专题:常见的酸 酸的通性,常见的碱 碱的通性
分析:分析装置的原理:要使气球变大就要使瓶中的气体减少或瓶中温度降低.可以根据物质之间混合时的反应特点方面进行分析、判断.
解答:解:
A、稀盐酸和锌反应生成氢气,气球变小,A不符合题意;
B、稀盐酸和碳酸钙反应生成二氧化碳,气球变小,B不符合题意;
C、氢氧化钙和二氧化碳发生反应,气球变大,C符合题意;
D、浓硫酸溶于水,放热,气体受热膨胀,气球变小,D不符合题意.
答案:C.
A、稀盐酸和锌反应生成氢气,气球变小,A不符合题意;
B、稀盐酸和碳酸钙反应生成二氧化碳,气球变小,B不符合题意;
C、氢氧化钙和二氧化碳发生反应,气球变大,C符合题意;
D、浓硫酸溶于水,放热,气体受热膨胀,气球变小,D不符合题意.
答案:C.
点评:本题主要考查了酸、碱、盐的化学性质,解此类题的关键是分析装置的原理,再根据酸、碱、盐的性质判断物质间反应时是否有气体生成或气体参加反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关对自行车的做法不合理的是( )
| A、在链条上涂油是为防止生锈 |
| B、钢圈可镀上其它金属如铬来防腐 |
| C、自行车脏了应用水冲洗 |
| D、被雨水淋湿的自行车先用干布擦,再用带油布擦 |
世界是物质的,而物质又是在不断运动变化的.请你判断下列哪一种变化与其它三种变化有着本质上的不同( )
A、 火药爆炸 |
B、 衣服晾干 |
C、 纸张燃烧 |
D、 粮食酿酒 |
2010年上海世博会的主题是“城市,让生活更美好”,下列与该主题不相符的是( )
| A、爱护城市绿化,珍惜城市之肺 |
| B、垃圾分类回收 |
| C、随意燃放烟花爆竹 |
| D、城市生活污水集中处理后排放 |
化学用语是最简明、信息丰富、国际通用的语言,下列对化学用语的表述正确的是( )
| A、N2 两个氮原子 |
| B、2H 两个氢元素 |
| C、2H2O 两个水分子 |
| D、Ca2+ 钙元素的化合价为+2价 |
洗衣机减轻了人们的劳动强度.下列说法中正确的是( )


| A、洗涤剂加水稀释后溶质的质量分数变大 |
| B、洗涤后衣服上一定没有残留洗涤剂 |
| C、洗涤后排出的液体一定是溶液 |
| D、洗涤时适当提高水温能加快洗衣粉的溶解 |
 膨化食品等常采用真空充气包装,小明、小红和小华对市场上销售的一种薯片发生了兴趣,因为薯片包装在充满气体的小塑料袋内,袋内的气体充得鼓鼓的,看上去好像一个小“枕头”(如图所示).他们认为这种充气包装技术,主要是为了使食品能够较长时间地保鲜、保质.那么,这是什么气体呢?
膨化食品等常采用真空充气包装,小明、小红和小华对市场上销售的一种薯片发生了兴趣,因为薯片包装在充满气体的小塑料袋内,袋内的气体充得鼓鼓的,看上去好像一个小“枕头”(如图所示).他们认为这种充气包装技术,主要是为了使食品能够较长时间地保鲜、保质.那么,这是什么气体呢?