题目内容
【题目】称取氯化钠和氯化钙的固体混合物14 g,放入烧杯中,加入96 g碳酸钠溶液恰好完全反应(反应的方程式为Na2CO3+CaCl2===CaCO3↓+2NaCl)。待反应完全后过滤,称得滤液的总质量为100 g。
(1)根据质量守恒定律,可知生成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
【答案】(1)10g (2)11.1g (3) 14.6%
【解析】
(2)根据化学方程式中各物质之间的质量比,利用碳酸钙沉淀的质量,列出比例式,即可计算出固体混合物中氯化钙的质量。
(3) 根据题意,反应完全后过滤,所得滤液为氯化钠溶液,滤液中的溶质NaCl包括混合物中原有的NaCl和反应生成的NaCl;根据上述方程式可以求出生成NaCl的质量,而混合物中原有的NaCl的质量=混合物总质量-氯化钙的质量,据此可以计算出滤液中溶质的质量,然后根据溶质质量分数=![]() ×100%计算即可。
×100%计算即可。
(1) 根据质量守恒定律可知,反应前物质质量总和=反应后物质质量总和,即反应前所有混合物的总质量=滤液的总质量+生成沉淀的质量,所以生成沉淀的质量=14g+96g-100g=10g。
(2)设固体混合物中含氯化钙的质量为x,反应后生成氯化钠的质量为y。
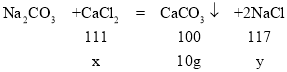
![]()
x=11.1g
y=11.7g
(3)原混合物中含氯化钠的质量=14g-11.1g=2.9g
则所得滤液中溶质的质量分数=![]() ×100%=14.6%
×100%=14.6%
答:(2)固体混合物中氯化钙的质量是11.1g;
(3)所得滤液中溶质的质量分数为14.6%。

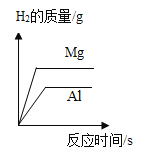
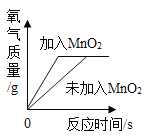
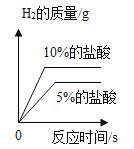
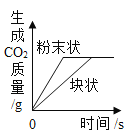
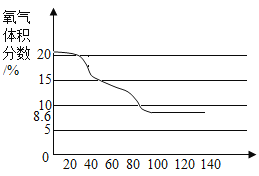
【题目】影响化学反应速率的因素很多。下列图像表达的化学反应过程,与实际情况不相符的是( )
选项 | A | B | C | D |
化学反应 | 等质量的镁片和铝片分别与足量相同的稀硫酸反应 | 等质量相同的过氧化氢溶液分别在有、无 | 等质量不同浓度的盐酸分别与足量相同的锌片反应 | 等质量形状不同的大理石分别与足量相同的稀盐酸反应 |
图像 |
|
|
|
|
A.AB.BC.CD.D