题目内容
下表列出了硝酸钾在不同温度时的溶解度.
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
某兴趣小组做了以下实验:

(1)上述溶液中的溶剂是 ,上述实验过程中得到的溶液一定属于不饱和溶液的是 (填数字序号),⑤所对应的实验现象是 .
(2)实验过程中,溶质的质量分数一定相等的是 (填数字序号).
(3)为了防止水体污染,小组同学提出了如下方案处理实验后的废液:
步骤I:将⑤继续冷却至0℃,过滤,共可回收得到KNO3固体 g.
步骤II:向滤液中加入 g水稀释,得到溶质的质量分数为1%的KNO3稀溶液,将此溶液做为花肥使用.
故答案为(1)H2O(或水),①③④析出晶体(合理答案均可得分).(2)②⑤.
(3)步骤I:61.7.步骤II:1216.7
【解析】
试题分析:(1)硝酸钾溶于水得到的溶液中溶剂是水,20℃时硝酸钾的溶解度为31.6g,将25g硝酸钾溶于100g水中得到的溶液①为不饱和溶液,再加入25g时得到的溶液②为饱和溶液且有硝酸钾剩余50g﹣31.6g=18.4g,将②溶液升温到50℃,因50℃时硝酸钾的溶解度为85.5g,因此得到的溶液③为不饱和溶液,再加入25g得到的溶液④仍为不饱和溶液,再降温到20℃时得到的溶液⑤是饱和溶液且析出硝酸钾晶体75g﹣31.6g=43.4g故属于不饱和溶液的是①③④(2)②⑤都是20℃时的饱和溶液,因此溶质质量分数一定相等(3)步骤Ⅰ将⑤继续冷却至0℃,0℃时硝酸钾的溶解度为13.3g,因此析出晶体的质量为75g﹣13.3g=61.7g步骤Ⅱ,滤液是0℃时硝酸钾的饱和溶液,即100g水中溶解了13.3g硝酸钾,设加水的质量为x根据溶质质量分数的计算公式可得1%=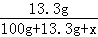 ×100%
x=1216.7g
×100%
x=1216.7g
考点:固体溶解度的影响因素;饱和溶液和不饱和溶液;用水稀释改变浓度的方法.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案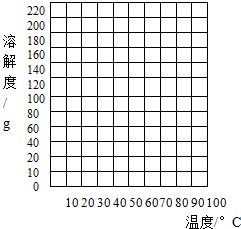 下表列出了硝酸钾在不同温度下的溶解度:
下表列出了硝酸钾在不同温度下的溶解度:| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度(g) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
(2)在20℃时,向100g水中加入30g硝酸钾,形成的硝酸钾溶液是
(3)请依据上表给定的数据在右边的表格中绘制溶解度曲线
(4)如要将100g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶液,需加入水的质量为
| 温度/℃ | 10 | 20 | 30 | 40 |
| 溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 |
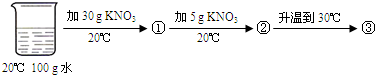
| A、①②③中溶液都为不饱和溶液 |
| B、②③中都含有末溶解的固体 |
| C、①②③中溶液的质量相等 |
| D、③中溶质质量分数最大 |

