题目内容
一定量的铜锌合金样品与80g溶质质量分数为24.5%的稀硫酸恰好完全反应.计算:
(1)样品中锌的质量.
(2)将上述稀硫酸80g加水稀释至200g,所得溶液溶质的质量分数.
解:(1)设样品中锌的质量是x
Zn+H2SO4=ZnSO4+H2↑
65 98
x 80g×24.5%

x=13g
(2)将上述稀硫酸80g加水稀释至200g后硫酸的质量不会变化,故所得溶液溶质的质量分数为 ×100%=9.8%
×100%=9.8%
答:(1)样品中锌的质量为13g.
(2)将上述稀硫酸80g加水稀释至200g,所得溶液溶质的质量分数为9.8%.
分析:(1)依据反应的硫酸的质量利用方程式可求反应的锌的质量;
(2)依据溶液稀释前后溶质的质量不会变化分析解答;
点评:此题是对化学方程式以及溶液有关计算的考查,题型基础难度不大,属基础性知识考查题;
Zn+H2SO4=ZnSO4+H2↑
65 98
x 80g×24.5%

x=13g
(2)将上述稀硫酸80g加水稀释至200g后硫酸的质量不会变化,故所得溶液溶质的质量分数为
 ×100%=9.8%
×100%=9.8%答:(1)样品中锌的质量为13g.
(2)将上述稀硫酸80g加水稀释至200g,所得溶液溶质的质量分数为9.8%.
分析:(1)依据反应的硫酸的质量利用方程式可求反应的锌的质量;
(2)依据溶液稀释前后溶质的质量不会变化分析解答;
点评:此题是对化学方程式以及溶液有关计算的考查,题型基础难度不大,属基础性知识考查题;

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
a、常熟白雪冰箱厂新购进了一批黄铜(铜锌合金).为了测定这批黄铜中铜的质量分数,化验人员将取来的样品先加工成粉未,然后利用该粉末与稀硫酸在烧杯内发生反应.在所进行的三次实验中,只有一次所取用的稀硫酸与黄铜样品是恰好完全反应的.有关实验数据记录如下:
请分析实验数据,完成下列问题:
(1)黄铜样品与稀硫酸恰好完全反应时两种物质的质量之比为 ,该黄铜样品中铜的质量分数为 .
(2)计算黄铜样品与稀硫酸恰好完全反应后所得的溶液中溶质的质量分数.(计算结果精确到0.1%)
b、课题小组为测定某石灰石样品中CaCO3的含量,取10g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
(1)样品中CaCO3的含量是多少?
(2)所用稀盐酸的质量分数是多少?
我解答 小题(请在横线上填写题号“a”或“b”,以确认你的选择).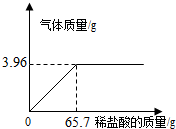
| 实验次数 | 1 | 2 | 3 |
| 所取黄铜样品的质量/g | 10.0 | 10.0 | 20.0 |
| 加入稀硫酸的质量/g | 100.0 | 80.0 | 80.0 |
| 反应后烧杯内剩余物质的质量/g | 109.8 | 89.8 | 99.8 |
(1)黄铜样品与稀硫酸恰好完全反应时两种物质的质量之比为
(2)计算黄铜样品与稀硫酸恰好完全反应后所得的溶液中溶质的质量分数.(计算结果精确到0.1%)
b、课题小组为测定某石灰石样品中CaCO3的含量,取10g石灰石样品放在烧杯中,然后向其中注入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参与反应).随反应进行,注入稀盐酸的质量与反应得到气体的质量呈如图所示关系.请完成下列计算内容:
(1)样品中CaCO3的含量是多少?
(2)所用稀盐酸的质量分数是多少?
我解答
