题目内容
我市北部山区盛产石灰石,石灰石的主要成分是碳酸钙.
(1)实验室中常用石灰石制取二氧化碳,化学的反应方程式为______;其中碳酸钙中钙元素的质量分数为______.
(2)某校课外活动小组为了解石灰石资源的品质,对当地石材进行化学分析:取12.5g石灰石颗粒样品,置于烧杯中并加入足量稀盐酸,充分反应后称得混合物的总质量减少了4.4g.则该石灰石中含碳酸钙的质量分数是______.
解:(1)实验室中常用石灰石和稀盐酸制取二氧化碳,产生氯化钙、水和二氧化碳,化学反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
碳酸钙中钙元素的质量分数为=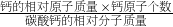 ×100%=
×100%= ×100%=40%;
×100%=40%;
故答案为:(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;40%;
(2)混合物的总质量减少了4.4g,说明生成了4.4g二氧化碳,
设样品中的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
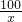 =
=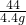
x=10g
石灰石样品中碳酸钙的质量分数= ×100%=80%
×100%=80%
答:该石灰石中含碳酸钙的质量分数是80%.
分析:(1)实验室中常用石灰石和稀盐酸制取二氧化碳,产生氯化钙、水和二氧化碳,写出化学反应方程式;根据化合物中某元素的质量分数公式计算;
(2)碳酸钙和盐酸反应生成二氧化碳气体,反应后混合物的总质量减少的质量就是生成二氧化碳的质量,根据二氧化碳可计算碳酸钙的质量,进而计算碳酸钙的质量分数.
点评:本题主要考查二氧化碳的实验室制法及运用化学方程式和质量分数公式进行计算的能力,难度不大,注意根据化学方程式计算时一定要注意格式和计算的准确性.
碳酸钙中钙元素的质量分数为=
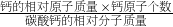 ×100%=
×100%= ×100%=40%;
×100%=40%;故答案为:(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;40%;
(2)混合物的总质量减少了4.4g,说明生成了4.4g二氧化碳,
设样品中的碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
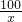 =
=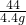
x=10g
石灰石样品中碳酸钙的质量分数=
 ×100%=80%
×100%=80%答:该石灰石中含碳酸钙的质量分数是80%.
分析:(1)实验室中常用石灰石和稀盐酸制取二氧化碳,产生氯化钙、水和二氧化碳,写出化学反应方程式;根据化合物中某元素的质量分数公式计算;
(2)碳酸钙和盐酸反应生成二氧化碳气体,反应后混合物的总质量减少的质量就是生成二氧化碳的质量,根据二氧化碳可计算碳酸钙的质量,进而计算碳酸钙的质量分数.
点评:本题主要考查二氧化碳的实验室制法及运用化学方程式和质量分数公式进行计算的能力,难度不大,注意根据化学方程式计算时一定要注意格式和计算的准确性.

练习册系列答案
相关题目