题目内容
【题目】某兴趣小组同学在实验室探究二氧化碳的制取,用块状大理石(其中的杂质不溶于水也不与酸反应)和10%的稀盐酸制取二氧化碳,反应的化学方程式为____________;他们检验二氧化碳是否收集满的操作是_______________。实验后,同学们发现发生装置中仍有固体剩余,可是却不再有气泡产生,对此小组同学产生了疑问,并继续探究。
(提出问题)不再产生气泡的原因是什么?
(猜想假设)猜想一:盐酸已经完全反应;
猜想二:大理石中的碳酸钙已完全反应(即剩余固体只是杂质);
猜想三:生成物或杂质附着在大理石表面,阻止反应继续进行。
(实验探究)小组同学先用洁净的烧杯A取反应后的清液,并用烧杯B、C配制CO2水溶液和CaCl2溶液。(如图所示)

实验1:用三支试管各取试剂X少许,分别向其中滴加A、B、C三种溶液,溶液A、B均使X变为_______色,溶液C未使X变色。其中,试剂X为_______;溶液C不呈酸性。该步实验的目的是_______________。
实验2:用pH试纸分别测溶液A、B的酸碱性,具体操作是:取少量待测液滴在pH试纸上,然后与____________对比。测得结果是:溶液A的pH=2,溶液B的pH=6。
通过实验1和实验2可得出结论“猜想一不成立”,即“反应后盐酸还有剩余”。
实验3:小明将反应容器充分振荡,使剩余固体与液体充分接触,观察到仍无气泡产生。由此得出结论“猜想三不成立”。
实验4:向实验3后的容器中继续加少量_________,又有气泡产生;一段时间后,不再产生气泡,仍有固体剩余。由此得出结论“猜想二不成立”。
(得出结论)根据以上探究活动可知:影响反应能否进行的因素之一是__________________。
(反思交流)小组同学讨论,又是出新的观点“可能是盐酸浓度太小,反应太慢,无法观察气泡产生”。并设计实验5:当实验4中观察不到气泡时,测得容器中溶液的pH为a;放置一段时间后,再次测其pH为b。若a_______b(选填“>”“<”或“=”),则该猜想成立。(由于稀盐酸浓度较小,其挥发性对实验的影响可以忽略不计)
【答案】![]() 将燃着的木条放在集气瓶口 红 石蕊溶液 排除CaCl2 对反应后溶液酸碱性的影响 标准比色卡 10%的盐酸(或浓盐酸) 反应物的浓度大小 <
将燃着的木条放在集气瓶口 红 石蕊溶液 排除CaCl2 对反应后溶液酸碱性的影响 标准比色卡 10%的盐酸(或浓盐酸) 反应物的浓度大小 <
【解析】
某兴趣小组同学在实验室探究二氧化碳的制取,用块状大理石和10%的稀盐酸制取二氧化碳,碳酸钙与稀盐酸反应产生氯化钙、水和二氧化碳的化学方程式为:![]() ;二氧化碳没有助燃性,检验二氧化碳是否收集满的操作是:将燃着的木条放在集气瓶口,观察是否熄灭;
;二氧化碳没有助燃性,检验二氧化碳是否收集满的操作是:将燃着的木条放在集气瓶口,观察是否熄灭;
实验探究:
实验1:用三支试管各取试剂X少许,分别向其中滴加A、B、C三种溶液,溶液A、B均使X变为红色,溶液C未使X变色。其中,试剂X为石蕊溶液,石蕊遇酸性溶液变红;溶液C不呈酸性。该步实验的目的是:排除CaCl2 对反应后溶液酸碱性的影响,氯化钙溶液显中性;
实验2:用pH试纸分别测溶液A、B的酸碱性,具体操作是:取少量待测液滴在pH试纸上,然后与标准比色卡对比。测得结果是:溶液A的pH=2,溶液B的pH=6。
通过实验1和实验2可得出结论“猜想一不成立”
实验3:小明将反应容器充分振荡,使剩余固体与液体充分接触,观察到仍无气泡产生。由此得出结论“猜想三不成立”。
实验4:向实验3后的容器中继续加少量10%盐酸,又有气泡产生;一段时间后,不再产生气泡,仍有固体剩余。由此得出结论“猜想二不成立”。
得出结论:根据以上探究活动可知:影响反应能否进行的因素之一是:反应物的浓度大小,随着反应的进行,稀盐酸的浓度变小,不能继续参与反应;
反思交流:小组同学讨论,又是出新的观点“可能是盐酸浓度太小,反应太慢,无法观察气泡产生”。并设计实验5:当实验4中观察不到气泡时,测得容器中溶液的pH为a;放置一段时间后,再次测其pH为b。若a<b,说明稀盐酸继续参与参加反应,溶液pH变大;则该猜想成立。

【题目】(1)不同实验对反应速率有不同要求。某同学探究CO2制取实验,按要求答题。 限选控制反应速率的方法:①反应物的浓度 ②反应物的状态
限选试剂:A.稀盐酸 B.浓盐酸 C.块状石灰石 D.碳酸钠溶液 E.粉末状石灰石
填写下表并回答相关问题
实验名称 | 控制速率的方法 | 所选用的最佳试剂 |
灭火器反应原理 | ① | ___________和D |
CO2的实验室制法 | ___________; | A和C |
写出实验室制备CO2的化学反应方程式:______________________。
(2)己知:CO2和SO2既有相似性,又有差异性。
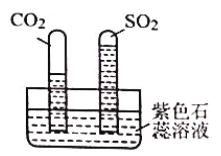
实验:水槽中滴入紫色石蕊溶液,将收集满两种气体的试管同时倒立于水槽中,片刻后实验现象如下图所示,说明相同条件下的溶解性:SO2 ___________(填“>”或“<”)CO2,试管内溶液变成___________色。