题目内容
【题目】将10.0%的NaOH溶液逐滴加入到50g稀盐酸中,得到混合液的温度与加入NaOH溶液的质量关系如图。下列说法正确的是( )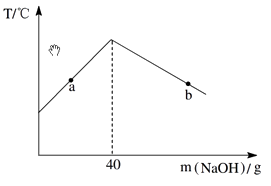
A.a点时的混合液能与Fe发生置换反应
B.b点时的混合液能与Mg(NO3)2发生两种复分解反应
C.加入40 g NaOH溶液时混合液pH>7
D.稀盐酸中HCl的质量分数为3.65%
【答案】A
【解析】A、酸碱中和反应放热,所以反应中溶液的温度逐渐升高,反应结束后由于散热,温度又逐渐降低,因此可知加入氢氧化钠溶液的质量为40g时,刚好完全反应,则a点盐酸有剩余,所以a点时的混合液能与Fe发生置换反应,A符合题意;
B 、由上述分析可知,b点时氢氧化钠溶液过量,溶质为氯化钠和氢氧化钠,混合液中氢氧化钠能与Mg(NO3)2发生两种复分解反应生成氢氧化镁沉淀和硝酸钠,C不符合题意;
C、 加入40 g NaOH溶液时刚好完全反应,所以混合液pH=7,C不符合题意;
D、刚好完全反应,消耗氢氧化钠的质量为40g×10.0%=4g;设稀盐酸中HCl的质量为x
NaOH + | HCl= NaCl+H2O |
40 | 36.5 |
4g | x |
40/4g=36.5g/x x=3.65g
稀盐酸中HCl的质量分数为3.65÷50g=7.3%,D不符合题意;
所以答案是:A.
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目